мвр что это в кардиологии
Клиническая картина, классификация и диагностика мерцательной аритмии
Клинические проявления трепетания и фибрилляции предсердий многообразны: от бессимптомного течения до жизне-угрожающих состояний, сопровожда-ющихся выраженными нарушениями гемодинамики, и зависят от частоты ритма желудочков, продолжительности аритмии, функционального состояния миокарда и тяжести основной сердечной патологии. Типичными симптомами ФП являются: усиленное и не регулярное сердцебиение, перебои в работе сердца, чувство нехватки воздуха, повышенная утомляемость, плохая переносимость физических нагрузок и потливость. Также могут отмечаться головокружение, обмороки, боли в области сердца, полиурия. Большинство больных отмечают появление пароксизма аритмии в момент перехода от синусового ритма к ФП.
Наличие провоцирующих факторов развития приступа (физические нагрузки, эмоциональное напряжение или прием алкоголя), наличие в анамнезе артериальной гипертензии, ишемической болезни, пороков сердца, сердечной недостаточности, заболевания периферических артерий, цереброваскулярной болезни, инсульта, сахарного диабета или хронического заболевания легких, злоупотребление алкоголем, наличие родственников, страдавших ФП.
У 60% больных с пароксизмальной формой ФП синусовый ритм восстанавливается самостоятельно в течение 24 ч, а в 20% случаев приступ аритмии продолжается более 2-х суток. Только у 25% больных с пароксизмальной формой ФП она переходит в постоянную форму.
При обследовании пациентов с ФП и ТП рекомендована оценка наличия признаков гемодинамической нестабильности и недостаточности кровообращения. При физикальном обследовании выявляется аритмичная сердечная деятельность, наличие дефицита пульса, вероятно смещение границ сердечной тупости при перкуссии, наличие патологических шумов, признаков сердечной недостаточности (хрипы в легких, отеки на ногах, гепатомегалия, ритм галопа). В большинстве случаев ФП и ТП, а также вне аритмии при физикальном обследовании пациентов признаков гемодинамической нестабильности и недостаточности кровообращения не отмечается.
Классификация фибрилляции предсердий.
В зависимости от клинической картины, длительности и вероятности спонтанного купирования эпизодов аритмии традиционно выделяют 5 типов ФП: впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая и постоянная формы.
Любой впервые диагностированный эпизод ФП вне зависимости от длительности и выраженности симптомов считают впервые выявленной ФП.
— Пароксизмальной ФП именуют повторно возникающую (2 и более эпизодов) ФП, способную самостоятельно прекращаться до истечения 7 суток от момента начала приступа. К пароксизмальной ФП также относят ФП, купированную с применением медикаментозной или электрической кардиоверсии в сроки до 48 часов от момента начала аритмии.
— Персистирующей является первично или повторно возникшая ФП длительностью более 7 суток, не способная к спонтанному прерыванию и требующая для своего устранения проведения специальных мероприятий (обычно, электрической кардиоверсии).
— Длительно персистирующей именуют ФП, продолжительностью более года, если принимается решение о восстановлении синусового ритма с помощью кардиоверсии или радикального интервенционного (катетерная аблация) и/или хирургического лечения.
— Постоянной или хронической именуется ФП продолжительностью более 7 суток, если попытки ее устранения неэффективны или не предпринимаются по тем или иным причинам. Последнее подразумевает отказ от проведения кардиоверсии, а также любых попыток радикального интервенционного и/или хирургического лечения аритмии.
Классификация по течению и длительности аритмии
Формы ФП
Характеристика
независимо от длительности и тяжести симптомов любой первый эпизод ФП
до 7 дней, синусовый ритм восстанавливается спонтанно, обычно в течение 48 час., более чем через 48 ч вероятность спонтанной кардиоверсии низкая; или эпизоды ФП, по поводу которых была проведена кардиоверсия в течение первых 7 суток
длительность эпизода ФП превышает 7 дней (для восстановления ритма необходима медикаментозная или электрическая кардиоверсия)
ФП продолжается в течение ≥1 года и выбрана стратегия контроля ритма (предполагается восстановление ритма)
когда пациент и врач считают возможным сохранение аритмии (кардиоверсия не проводится)
При фибрилляции предсердий, так же, как при ТП, в зависимости от частоты ритма желудочков во время бодрствования различают: 1) нормосистолический вариант (частота в диапазоне от 60 до 100 в минуту; 2) тахисистолический вариант (частота более 100 в минуту) ии 3) брадисистолический вариант (частота менее 60 в минуту).
Качество жизни (КЖ) пациентов с ФП значительно снижается, что обусловлено выраженностью симптомов, связанных с аритмией, главным образом — апатией, учащенным сердцебиением, одышкой, дискомфортом в области грудной клетки, нарушением сна и психосоциальным стрессом. На фоне медикаментозной и интервенционной терапии наблюдается улучшение психологических и физических параметров, но пока недостаточно исследований, сравнивающих преимущества указанных методик, а также оценивающих информативность специфических шкал для оценки КЖ у пациентов с ФП. Так, EHRA была разработана шкала оценки тяжести симптомов при ФП Подобная шкала применяется в Канаде (the Canadian Cardiovascular Society Severity of Atrial Fibrillation Scale). В дальнейшем первый вариант шкалы EHRA была модифицирован в 2014 г., после чего появилось разделение 2 класса симптомов на легкую (2а) и умеренную (2b) степень тяжести. В связи с этим, пациенты, имеющие выраженное снижение КЖ в связи с ФП (2b класс), имеют определенное преимущество при выборе стратегии контроля ритма на начальном этапе лечения. Это имеет особенно важное значение, так как среди общего количества пациентов с ФП только 25-40% имеют минимальную симптоматику, но при этом 15-30% испытывают серьезный дискомфорт и ограничение физической активности в связи с клиническими проявлениями заболевания. Таким образом, модифицированная шкала EHRA должна использоваться для выбора лечения, ориентированного на выраженность симптоматики при ФП, а также для динамического наблюдения за течением заболевания.
Классификация по выраженности клинических симптомов. Модифицированная шкала оценки симптомов EHRA [2]
Модифицированная оценка EHRA
ЭКГ-диагностика нарушений функции автоматизма синусового узла, замещающих комплексов и ритмов
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Несмотря на все разнообразие использующихся методов функциональной диагностики, в практике врача-кардиолога свою прочную позицию занимает электрокардиография как «золотой стандарт» диагностики нарушений сердечного ритма и проводимости.
Электрокардиография позволяет диагностировать и выявлять блокады и аритмии сердца, гипертрофию различных отделов сердца, определять признаки ишемического повреждения миокарда, а также косвенно судить об электролитных нарушениях, воздействии различных лекарственных препаратов, экстракардиальных заболеваниях. Некоторые электрокардиографические признаки в совокупности с характерными клиническими проявлениями объединены в клинико-электрокардиографические синдромы, которых в настоящее время насчитывается более 40 видов.
Данный обзор посвящен наиболее сложному разделу ЭКГ-диагностики – аритмиям сердца. Многообразие нарушений сердечного ритма, в т. ч. обусловленных дисфункцией синусового узла, значительно затрудняет их диагностику. Тем не менее актуальность адекватной оценки нарушений функции автоматизма синусового узла не вызывает сомнений.
В обзоре представлены современные взгляды на ЭКГ-диагностику нарушений функции автоматизма синусового узла. Дана характеристика основных причин нарушений сердечного ритма, представлены иллюстрированные электрокардиограммами критерии диагностики нарушений функции автоматизма синусового узла. В статье приведена современная классификация нарушений сердечного ритма и проводимости, а также даны алгоритмы дифференциального диагноза между различными аритмиями сердца.
Ключевые слова: автоматизм сердца, синусовый узел, синусовый ритм, выскакивающие сокращения, блуждающий ритм, замещающие ритмы, медленный предсердный ритм, узловой ритм, идиовентрикулярный ритм, синдром слабости синусового узла, блокады сердца, остановка синусового узла, асистолия предсердий.
Для цитирования: Задионченко В.С., Ялымов А.А., Шехян Г.Г., Щикота А.М. ЭКГ-диагностика нарушений функции автоматизма синусового узла, замещающих комплексов и ритмов // РМЖ. Кардиология. 2016. № 9. С. –539.
Для цитирования: Задионченко В.С., Ялымов А.А., Шехян Г.Г., Щикота А.М. ЭКГ-диагностика нарушений функции автоматизма синусового узла, замещающих комплексов и ритмов. РМЖ. 2016;9:530-539.
ECG diagnosis of sinus node automaticity dysfunctions, substituting complexes and rhythms
V.S. Zadionchenko, A.A. Yalymov, G.G. Shekhyan, A.M. Shchikota
A.I. Evdokimov Moscow State Medical and Dental University, Moscow, Russia
Despite a variety of functional tests used by cardiologists, electrocardiography (ECG) remains the gold standard for the diagnosis of heart rhythm and conduction disorders. Currently, electrocardiography can be done almost everywhere, however, ECG interpretation by an expert is performed rarely. ECG helps to diagnose cardiac hypertrophy, heart block and arrhythmias, myocardial ischemic injury as well as to identify extracardiac pathologies, electrolyte imbalances, and the effects of various drugs. Electrocardiographic signs and typical clinical symptoms can be grouped into more than 40 clinical electrocardiographic syndromes. Long QT syndrome, post-tachycardia syndrome, Frederick syndrome, and Wolff-Parkinson-White syndrome are the best known conditions. The paper discusses the most difficult part of ECG diagnostics, i.e., heart arrhythmias. A variety of heart rhythm problems (including arrhythmias caused by sinus dysfunction) make their diagnosis difficult. Nevertheless, adequate interpretation of sinus node automaticity dysfunction is an important issue. The paper summarizes recent opinion on electrocardiographic diagnostics of this pathology. Major causes of heart rhythm problems are described. Diagnostic criteria sinus node automaticity dysfunction are illustrated by ECGs. Finally, current grading system of heart rhythm and conduction disorders as well as algorithms for the differential diagnosis of arrhythmias are reviewed.
Key words: heart automaticity, sinus node, sinus rhythm, escape beat, wandering pacemaker, substituting rhythms, slow atrial rhythm, junctional rhythm, idioventricular rhythm, sick sinus syndrome, heart block, sinus arrest, atrial asystole.
For citation: Zadionchenko V.S., YalymovA.A., Shekhyan G.G., Shchikota A.M. ECG diagnosis of sinus node automaticity dysfunctions, substituting complexes and rhythms // RMJ. Cardiology. 2016. № 9. P. –539.
Статья посвящена ЭКГ-диагностике нарушений функции автоматизма синусового узла, замещающих комплексов и ритмов
Синусовый узел (синоаурикулярный узел, узел Киса – Флака) (СУ) является нормальным водителем ритма сердца. Пейсмейкерные клетки СУ (водителя ритма первого порядка) обладают наибольшим автоматизмом, они генерируют 60–90 импульсов в минуту.
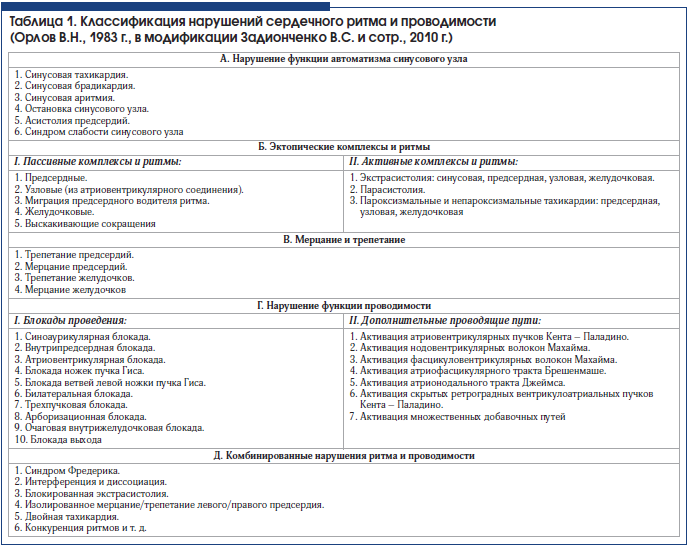
Нарушения функции автоматизма СУ можно подразделить на виды, имеющие и не имеющие гемодинамическую значимость, что, в свою очередь, делает крайне актуальной своевременную и правильную их диагностику, что позволяет назначить адекватную терапию, избежать (в т. ч. и ятрогенных) ошибок в процессе лечения, проводить профилактику развития внезапной смерти и других осложнений. В таблице 1 представлена классификация нарушений ритма и проводимости [1–5].
По этиологии нарушения ритма сердца можно разделить на следующие основные виды:
1. Дисрегуляторные или функциональные: связанные с нарушениями нейроэндокринной регуляции, вегетативной дисфункцией, психогенными воздействиями, переутомлением, рефлекторными влияниями (гастрит, язвенная болезнь, аэрофагия, синдром Ремхельда, желчнокаменная болезнь, нефроптоз, мочекаменная болезнь, колит, запор, метеоризм, панкреатит, межпозвоночная грыжа, эмболия в систему легочной артерии, опухоли средостения, бронхолегочные процессы, плевральные спайки, грудные операции, заболевания половых органов, травмы черепа, опухоли мозга, рассеянный склероз).
2. Миогенные или органические: связанные с болезнями миокарда (кардиомиопатия, миокардит, постмиокардитический кардиосклероз, дистрофия миокарда), с повреждениями кардиомиоцитов, возникающими на фоне ишемической болезни сердца (инфаркт миокарда, ишемическая кардиомиопатия), гипертонической болезни, пороков сердца.
3. Токсические: возникающие под воздействием лекарственных препаратов (сердечные гликозиды, анестетики, транквилизаторы, антидепрессанты, нейролептики, эуфиллин и его аналоги, адреномиметики (адреналин, нор-адреналин, мезатон, добутамин, дофамин, сальбутамол), ацетилхолин, ваголитики (атропин), глюкокортикостероиды, АКТГ, антиаритмические препараты, цитостатики, противовирусные препараты, противогрибковые препараты, антибиотики, диуретики, эфир, алкоголь, кофеин, никотин, соли тяжелых металлов, бензолы, угарный газ, отравление грибами, инфекции, эндогенная интоксикация при онкопатологии, уремия, желтуха и т. д.
4. Электролитные: гипокалиемия, гиперкалиемия, гипокальциемия, гиперкальциемия, гипомагнезиемия.
5. Дисгормональные: тиреотоксикоз, гипотиреоз, феохромоцитома, пубертатный возраст, климакс, беременность, гипопитуитаризм, дисфункция яичников, предменструальный синдром, тетания.
6. Врожденные: врожденные нарушения атриовентрикулярного (АВ) проведения, синдром удлиненного QT, синдромы предвозбуждения желудочков (WPW, CLC и др.).
7. Механические: катетеризация сердца, ангиография, операции на сердце, травмы сердца.
8. Идиопатические.
ЭКГ-диагностика аритмий, обусловленных нарушением функции автоматизма синусового узла, осуществляется с помощью электрокардиографического исследования, которое позволяет выделить следующие основные их типы [1, 2, 4–16].
1. Синусовая тахикардия – это правильный ритм с неизмененными зубцами ЭКГ (зубец Р, интервал PQ, комплекс QRS и зубец T не отличаются от нормы) из синусового узла с частотой > 90 в 1 мин. Синусовая тахикардия в состоянии покоя редко превышает 150–160 сокращений в 1 мин (рис. 1) [1, 16].
Дифференциальный диагноз:
– суправентрикулярная непароксизмальная тахикардия;
– суправентрикулярная пароксизмальная тахикардия;
– трепетание предсердий 2:1;
– мерцание предсердий с тахисистолией желудочков;
– желудочковая пароксизмальная тахикардия.
Этиология:
– физиологическая тахикардия: физическая нагрузка, эмоции, страх, ортостатическая, врожденные особенности;
– неврогенная тахикардия: невроз, нейроциркуляторная астения;
– ССЗ: воспалительные и дегенеративные заболевания миокарда, пороки клапанов, коллапс, сердечная недостаточность, легочное сердце, инфаркт миокарда, артериальная гипертензия;
– медикаментозная и токсическая тахикардия: ваголитики (атропин), симпатикотоники (адреналин, норадреналин, мезатон, добутамин, дофамин), эуфиллин, кортикостероиды, АКТГ, кофеин, кофе, чай, алкоголь, никотин;
– инфекционные заболевания: ОРВИ, сепсис, пневмония, туберкулез и т. д.;
– прочее: кровопотеря, анемия.
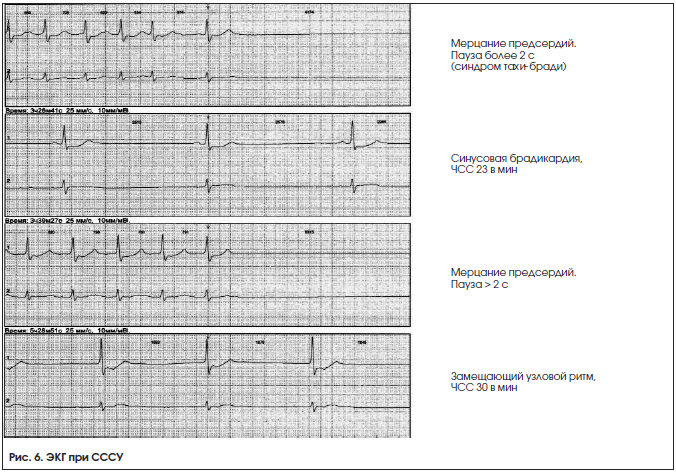
2. Синусовая брадикардия – замедление синусового ритма с ЧСС 2,5 с, возникающие вследствие остановки СУ, СА-блокады либо редких замещающих ритмов (рис. 6);
– синдром тахи-бради, чередование периодов тахикардии и брадикардии (рис. 6);
– редко приступы желудочковой тахикардии и/или мерцания желудочков;
– медленное и нестойкое восстановление функции СУ после экстрасистол, пароксизмов тахикардии и фибрилляции, а также в момент прекращения стимуляции при электрофизиологическом исследовании сердца (посттахикардиальная пауза, не превышающая в норме 1,5 с, при СССУ может достигать 4–5 с);
– неадекватное урежение ритма при использовании даже небольших доз бета-блокаторов. Сохранение брадикардии при введении атропина и проведении пробы с физической нагрузкой.
Классификация
Единой классификации СССУ не существует. В зависимости от характера поражения выделяют истинный (органический), регуляторный (вагусный), лекарственный (токсический) и идиопатический СССУ (рис. 6).
По клиническим проявлениям выделяют:
– латентный СССУ: изменений на ЭКГ нет, а патология СУ выявляется дополнительными функциональными методами исследования (ЭФИ);
– компенсированный СССУ: клинические изменения отсутствуют, есть изменения на ЭКГ;
– декомпенсированный СССУ: есть клинические и ЭКГ-проявления заболевания.
По ЭКГ-признакам выделяют:
– брадиаритмический вариант СССУ.
– синдром тахикардии-брадикардии.
Этиология:
– ССЗ: ИБС, миокардит, кардиомиопатии, оперативное повреждение СУ, ревматизм, врожденные пороки;
– рефлекторная: чувствительный каротидный синус, вагусные пробы, рефлекторные влияния при язвенной болезни, желчнокаменной болезни, грыже пищеводного отверстия диафрагмы;
– медикаментозная и токсическая: сердечные гликозиды (дигоксин, строфантин), опиаты, ацетилхолин, хинидин, бета-блокаторы, антагонисты кальция. Гиперкалиемия, интоксикация, гипоксемия;
– идиопатические формы.
Пассивные эктопические комплексы и ритмы
Пониженная активность СУ или полная блокада синусовых импульсов вследствие функционального или органического повреждения СУ вызывает включение в действие автоматических центров II порядка (клетки водителей ритма предсердий, АВ соединение), III порядка (система Гиса) и IV порядка (волокна Пуркинье, мускулатура желудочков).
Автоматические центры II порядка вызывают неизмененные желудочковые комплексы (наджелудочковый тип), тогда как центры III и IV порядка генерируют расширенные и деформированные желудочковые комплексы (желудочкового, идиовентрикулярного типа). Замещающий характер имеют следующие нарушения ритма: предсердные, узловые, миграция водителя ритма по предсердиям, желудочковые (идиовентрикулярный ритм), выскакивающие сокращения [1, 5, 16].
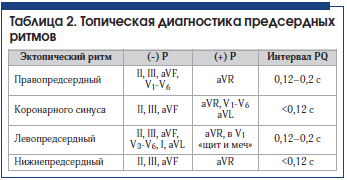
7. Предсердный ритм (медленный предсердный ритм) – очень медленный эктопический ритм с очагами генерирования импульсов в предсердиях (табл. 2).
Правопредсердный эктопический ритм – ритм эктопического очага, расположенного в правом предсердии. На ЭКГ регистрируется отрицательный зубец Р в V1-V6, II, III, aVF отведениях. Интервал PQ – обычной продолжительности, комплекс QRST не изменен.
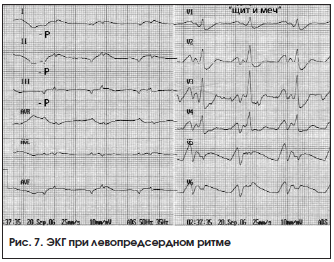
Ритм коронарного синуса (ритм венечной пазухи) – импульсы для возбуждения сердца исходят из клеток, расположенных в нижней части правого предсердия и коронарной синусной вены. Импульс распространяется по предсердиям ретроградно снизу вверх. Это приводит к регистрации отрицательных зубцов P во II, III, aVF отведениях. Зубец РaVR положительный. В отведениях V1-V6 зубец Р положительный либо 2-фазный. Интервал PQ укорочен и обычно 100 (101–120) в 1 мин. Ритм правильный, комплекс QRS не изменен (рис. 7).
Регулярный ритм с отрицательным зубцом P I, II, III, aVF, V3-V6 перед комплексом QRS. Зубец Р в отведении V1 с начальной округлой куполообразной частью, за которой следует заостренный пик – «щит и меч». Нормальный интервал P-R=0,12-0,2 с.
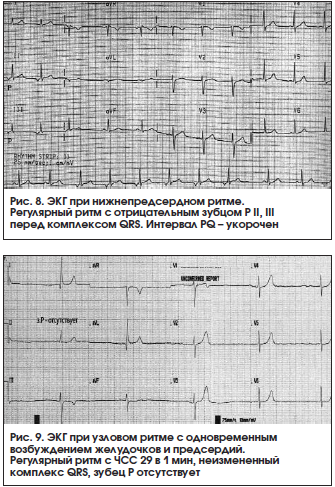
Нижнепредсердный эктопический ритм – ритм эктопического очага, расположенного в нижних отделах правого либо левого предсердий. Это приводит к регистрации отрицательных зубцов P во II, III, aVF отведениях и положительного зубца Р в aVR. Интервал PQ – укорочен (рис. 8).
Дифференциальный диагноз:
– синусовая аритмия;
– узловой ритм;
– миграция водителя ритма по предсердиям;
– трепетание предсердий;
– политопная предсердная экстрасистолия;
– предсердные ритмы (правопредсердный, левопредсердный, нижнепредсердный, ритм коронарного синуса).
8. Узловой ритм (АВ-ритм, замещающий АВ узловой ритм) – сердечный ритм под действием импульсов из АВ-соединения с частотой 40–60 в 1 мин. Различают 2 основных типа АВ-ритма [1]:
– узловой ритм с одновременным возбуждением предсердий и желудочков (узловой ритм без зубца P, узловой ритм с АВ-диссоциацией без зубца P): на ЭКГ регистрируется неизмененный либо незначительно деформированный комплекс QRST, зубец Р отсутствует (рис. 9);
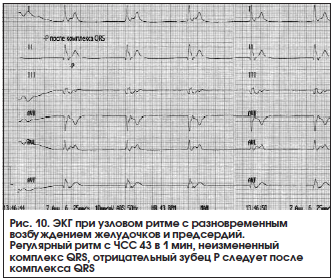
– узловой ритм с разновременным возбуждением желудочков, а затем предсердий (узловой ритм с ретроградным зубцом Р, изолированная форма АВ-ритма): на ЭКГ регистрируется неизмененный комплекс QRST, за которым следует отрицательный зубец P (рис. 10).
Дифференциальный диагноз:
– синусовая брадикардия;
– предсердный ритм;
– миграция водителя ритма по предсердиям;
– политопная предсердная экстрасистолия;
– идиовентрикулярный ритм.
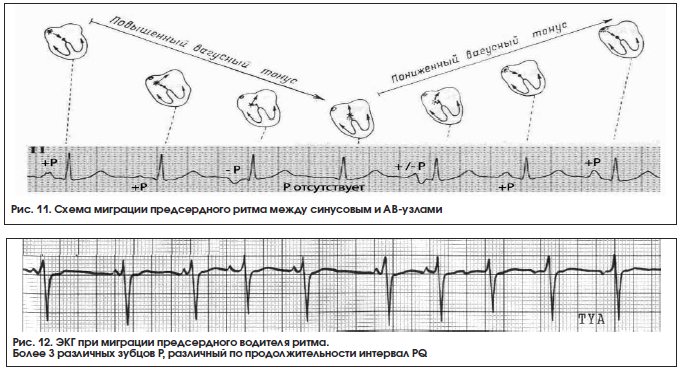
9. Миграция водителя ритма по предсердиям (блуждающий ритм, скользящий ритм, мигрирующий ритм, миграция водителя сердечного ритма, wandering pacemaker). Различают несколько вариантов блуждающего (странствующего) ритма [1, 5,15]:
Блуждающий ритм в СУ. Зубец Р имеет синусовое происхождение (положительный во II, III, аVF), но его форма изменяется при различных сердечных сокращениях. Интервал P-R остается относительно постоянным. Всегда налицо выраженная синусовая аритмия.
Блуждающий ритм в предсердиях. Зубец Р положительный во II, III, аVF, форма и размер его изменяются при различных сердечных сокращениях. Наряду с этим изменяется продолжительность интервала P-R.
Блуждающий ритм между синусовым и атриовентрикулярными узлами. Это наиболее частый вариант блуждающего ритма. При нем сердце сокращается под влиянием импульсов, периодически меняющих свое место: постепенно перемещаются от СУ, предсердной мускулатуры до АВ-соединения и снова возвращаются в СУ. ЭКГ критерии миграции водителя ритма по предсердиям – это ≥ 3 различных зубцов Р на серии сердечных циклов, изменение продолжительности интервала P-R. Комплекс QRS не изменяется (рис. 11, 12).
Этиология:
– рефлекторная: здоровые люди с ваготонией, чувствительный каротидный синус, вагусные пробы, интубация, глубокое дыхание;
– медикаментозные и токсические воздействия: сердечные гликозиды (дигоксин, строфантин), хинидин. Инфекционные заболевания, интоксикация;
– ССЗ: ИБС, ревматизм, пороки сердца, операции на сердце.
Дифференциальный диагноз:
– СА-блокада II ст., отказ СУ;
– АВ-блокада II ст.;
– мерцание предсердий;
– синусовая аритмия;
– политопная предсердная экстрасистолия.
10. Идиовентрикулярный (желудочковый) ритм (собственный желудочковый ритм, желудочковый автоматизм, внутрижелудочковый ритм) – импульсы сокращения желудочков возникают в самих желудочках. ЭКГ-критерии: уширенный и деформированный комплекс QRS (>0,12 с), ритм с ЧСС Литература
Нарушения ритма сердца при недифференцированной дисплазии соединительной ткани
Нарушения ритма и проводимости сердца при дисплазиях соединительной ткани (ДСТ) регистрируются достаточно часто. Так, по данным Перетолчиной Т. Ф. (2000) при электрокардиографическом (ЭКГ) исследовании у 2/3 пациентов с недифференцированной дисплази
Нарушения ритма и проводимости сердца при дисплазиях соединительной ткани (ДСТ) регистрируются достаточно часто (табл. 1). Так, по данным Перетолчиной Т. Ф. (2000) при электрокардиографическом (ЭКГ) исследовании у 2/3 пациентов с недифференцированной дисплазией соединительной ткани (НДСТ) выявляются те или иные отклонения, при Холтер-мониторировании (ХМ) — у 95%. По нашим наблюдениям в группе больных с различной степенью выраженности НДСТ нарушения ритма и проводимости регистрируются в 64,4% случаев.
Клиническое значение аритмий различно: у одних пациентов нарушения ритма, вызывая кардиальный дискомфорт, могут сказываться на качестве жизни, существенно не влияя на прогноз; у других — зачастую вне четкой связи с субъективной переносимостью — могут носить потенциально жизнеугрожающий характер; в части случаев нарушения ритма и проводимости могут манифестировать внезапной сердечной смертью. Результаты имеющихся на сегодняшний день исследований позволяют высказать предположение, что у пациентов с НДСТ патогенез аритмий сердца имеет мультифакторный характер, что и определяет их широкий спектр, различное прогностическое значение и различные лечебно-профилактические подходы.
Нарушения функции автоматизма синусового узла. Как отражение избыточных симпатических влияний наиболее часто регистрируется синусовая тахикардия.
При ХМ у пациентов фиксируются суточные колебания сердечного ритма от 54 до 120–130 уд/мин, в то время как на ЭКГ покоя частота сердечных сокращений (ЧСС) в половине случаев не превышает нормальных величин. Количество эпизодов синусовой тахикардии может варьировать от 10 до 416 в течение суток, максимальный объем в большинстве случаев приходится на период активной физической деятельности [10]. Часто выявляется синусовая аритмия (RRmax–RRmin > 0,15 c): в 10,0–43,2% случаев [4]. У 15–20% пациентов с НДСТ в основном в ночные часы во время сна могут регистрироваться кратковременные эпизоды синусовой брадикардии — от 1 до 427 с, по данным О. В. Тихоновой (2006), продолжительность максимального эпизода 2 минуты 11 секунд. Автор отмечает увеличение количества и продолжительности эпизодов у пациентов с выраженной формой НДСТ [10]. Синусовая брадикардия и аритмия чаще отмечаются у пациентов с исходной ваготонией.
Миграция водителя ритма. Данный вариант аритмий выявляется у 5,0–34,0% пациентов [5, 8, 10]. Частота выявления данного нарушения ритма увеличивается почти в два раза при проведении электрофизиологического исследования [11]. Чаще бывает миграция водителя ритма между синусовым и атриовентрикулярным узлом: сердце возбуждается под влиянием импульсов, исходящих последовательно из синусового узла, предсердий, атриовентрикулярного соединения и снова синусового узла [6]. При миграции водителя ритма ведущая роль синусового узла подавляется эктопическими водителями ритма временно. Несмотря на факт миграции водителя ритма по предсердиям и перинодальной зоне при проведении чреспищеводной электростимуляции сердца (ЧПЭС), независимо от степени НДСТ, время восстановления функции синусового узла и коррегированное время восстановления функции синусового узла обычно не превышают физиологическую норму [4]. Данное наблюдение позволяет говорить о сохраненной автоматической активности синусового узла и появлении эктопических комплексов вследствие изменения скорости диастолической спонтанной деполяризации латентных очагов автоматии с повышением автоматизма конкурирующих центров на фоне несбалансированных нейрогенных влияний. В. М. Яковлев с соавт. (2001) предполагает роль в формировании данного электрофизиологического феномена различной чувствительности мембран клеток синусового узла к ацетилхолину, катехоламинам. По данным Перетолчиной Т. Ф. (2000) частота выявления миграции водителя ритма увеличивается в 3 раза при нарастании тяжести синдрома вегетативной дисфункции и выраженности НДСТ.
Экстрасистолия. Предсердная и желудочковая экстрасистолия является наиболее распространенным нарушением ритма сердца среди пациентов с НДСТ. Появление активных эктопических комплексов может быть связано с изменением автоматической активности синусового узла, особенностями иннервации, формированием зон асинхронной деполяризации, активацией предсердных латентных очагов автоматии вследствие различия скорости реполяризации волокон миокарда и нарушения электрической гомогенности предсердий, реализующихся в условиях нарушения обмена в миокарде пациентов с НДСТ [4].
Частота предсердной экстрасистолии колеблется у больных с НДСТ при наличии пролапса митрального клапана (ПМК) от 4 до 90% [3]. Предсердная экстрасистолия у пациентов с НДСТ регистрируется с различными вариантами эктопических комплексов: чаще — с одним или несколькими отрицательными спайками в середине комплекса (II тип); несколько реже — с начальным положительным отклонением (I тип); редко — с начальным и конечным отрицательным отклонением (III тип) [4]. Возникновение наджелудочковых экстрасистол может быть связано с увеличением и изменением электрической активности клеток левого предсердия, подвергающегося раздражению в период систолы пролабирующей миксоматозно измененной створкой митрального клапана и/или струей митральной регургитации [11]. Так, по некоторым наблюдениям значимая наджелудочковая экстрасистолия (более 100 экстрасистол в минуту) регистрировалась только у пациентов с миксоматозной дегенерацией пролабирующих створок [11]. По нашим наблюдениям у пациентов с выраженными проявлениями НДСТ предсердная экстрасистолия покоя возрастает при физической нагрузке от 10–12 до 18–25 за 1 час [4].
Желудочковая экстрасистолия по данным различных авторов отмечается в 14–89% [3]. По некоторым данным у пациентов с эхокардиографическими признаками миксоматозной дегенерации митрального клапана среднее количество желудочковых экстрасистол в сутки и в час было достоверно большим, чем при отсутствии такового [11]. Эктопическая желудочковая активность у пациентов с НДСТ преимущественно представлена желудочковыми экстрасистолами I категории (I, II класс по Lown) и совпадает с периодами максимальных физических нагрузок [4]. Развитие желудочковой экстрасистолии помимо вегетативной дисфункции, гиперсимпатикотонии [4, 5, 12] может быть связано с аномальной тракцией папиллярных мышц при ПМК [11], механическим раздражением эндокарда, миксоматозно измененными хордами [3, 9]. В генезе желудочковых экстрасистолий может играть роль присутствие малой аномалии развития сердца — аномальных хорд (механическое раздражение эндокарда в месте прикрепления аномальных хорд, наличие в тканях аномальных хорд клеток Пуркинье) [3]. При расположении точек прикрепления хорд в области межжелудочковой перегородки или папиллярных мышц риск потенциально возможных нарушений ритма возрастает [8]. Существуют наблюдения о большей частоте регистрации желудочковых экстрасистол при снижении тканевого содержания магния [10].
У небольшой части пациентов отмечается сочетание предсердных и желудочковых экстрасистол. «Угрожающие» экстрасистолы в основном выявляются у лиц с яркими проявлениями ДСТ воронкообразной деформацией II–III степени, килевидной деформацией грудной клетки II степени [4, 10].
Синдром Вольфа–Паркинсона–Уайта. У определенной части больных с НДСТ может выявляться феномен преждевременного возбуждения желудочков (6,5–8,7–25%), обусловленный функционированием дополнительных путей проведения импульса [5, 8, 10]. У этих больных в большинстве случаев определяются пароксизмальные нарушения сердечного ритма в виде атриовентрикулярных пароксизмальных тахикардий.
Пароксизмальная тахикардия. В реализации патофизиологических механизмов пароксизмальной тахикардии у лиц с НДСТ предполагается участие дисфункции вегетативной нервной системы с преобладанием вагусных влияний, дополнительных проводящих путей, миксоматозного изменения атриовентрикулярной зоны [11]. Пароксизмальные нарушения ритма по данным большинства исследователей выявляются значительно чаще при проведении Холтер-ЭКГ, ЧПЭС в сравнении с регистрацией ЭКГ покоя. Так, при проведении ЧПЭС у больных с НДСТ провоцируются пароксизмы тахикардии в 72,9% случаев, по клиническим проявлениям и конфигурации ЭКГ аналогичные спонтанным ранее возникшим пароксизмам выявляются впервые в 27% случаев. По наблюдению Перетолчиной Т. Ф. (2000) пароксизмальные тахикардии у пациентов с НДСТ на ЭКГ покоя регистрируются в 5,8% случаев, при проведении Холтер-ЭКГ — в 32,5% наблюдений.
Совокупность дополнительных путей и дискретного проведения по АВ-соединению способствует развитию пароксизмальных суправентрикулярных тахикардий двух типов — ортодромной и антидромной. В первом случае, при наличии синусового ритма и признаков предвозбуждения желудочков, учащение стимуляции до порогового значения приводит к возвратному ходу волны возбуждения через добавочный пучок Кента и ретроградному возбуждению предсердий. В другом случае антеградное распространение импульса происходит через добавочный пучок, а ретроградное — через АВ-соединение, что на ЭКГ отражается появлением уширенного деформированного комплекса QRS за счет дельта-волны. Зубцы Р в том и другом случае имеют инвертированную форму, что свидетельствует о ретроградном распространении возбуждения на предсердия. Частота пароксизмов по нашим наблюдениям варьирует от 1 раза в 6 месяцев до 3–4 раз в неделю. При этом приступы возникают как при физической нагрузке, так и в покое или во время сна, характерна плохая субъективная переносимость аритмии. Антидромная реципрокная тахикардия регистрируется реже и имеет место у пациентов с синдромом Вольфа–Паркинсона–Уайта.
Пароксизмы желудочковой тахикардии регистрируются при НДСТ редко — 0,97–2,5% случаев по разным данным, при этом во всех случаях имели место выраженные проявления НДСТ с наличием деформаций грудной клетки II–III степеней [5, 10].
Регистрируемые при НДСТ пароксизмальная суправентрикулярная тахикардия, желудочковая экстрасистолия высоких градаций и пароксизмальная желудочковая тахикардия составляют угрожающую основу для возникновения фатальных нарушений ритма и внезапной смерти.
Фибрилляция/трепетания предсердий. Данные нарушения ритма в целом регистрируются редко — в 3,9–6,2% случаев при ХМ [5, 8]. Морфологическим субстратом электрогенеза фибрилляции/трепетания предсердий при НДСТ может служить генетически детерминированное несовершенство развития соединительной ткани в эмбрио- и онтогенезе и обусловленное ими нарушение межтканевых (миокардиальных и соединительнотканных структур) взаимодействий, проявляющееся электромеханической нестабильностью; наследственное соединительнотканное и гемодинамическое ремоделирование левого (значительно чаще) и правого предсердий; асимметрия клеточных структур правого и левого предсердий; трансформация импульса от синусового узла к АВ-соединению по цитологическим и функциональным (электрофизиологическим) структурам мышцы правого предсердия [11].
Нарушения проводимости. У большинства пациентов величина комплекса QRS не превышает пределов физиологической нормы (0,10 с). Изменение этого структурного показателя ЭКГ у лиц с НДСТ, не имеющих органического поражения сердечной мышцы, является отражением биоэлектрической неоднородности миокарда либо повышенной нагрузки на выходной тракт правого желудочка. Нарушения внутрижелудочковой проводимости различной локализации регистрируются не часто (табл. 2), имея как транзиторный, так и постоянный характер.
Чаще эти изменения выявляются на фоне физической нагрузки, реже — в покое [4]. По данным О. Д. Остроумовой (1995) все пациенты с блокадой правой ножки пучка Гиса имеют эхокардиографические признаки миксоматозной дегенерации септальной створки трикуспидального клапана. Как известно, именно в этой области начинается правая ножка пучка Гиса, располагаясь субэндокардиально.
Синоатриальные и атриовентрикулярные блокады у пациентов с НДСТ регистрируются не часто (табл. 2).
Синдром удлиненного интервала QT. Данный синдром как возможный прогностический критерий внезапной смерти описан во многих исследованиях у пациентов с ПМК. Частота его выявления варьирует в широких пределах в зависимости от метода диагностики: при регистрации ЭКГ-покоя — 2,5–26,5%, при Холтер-ЭКГ — до 35,7%, при ЧПЭС — до 42,6% [11].
Несмотря на сложный многокомпонентный аритмогенез в каждом конкретном клиническом наблюдении, по результатам многочисленных исследований отмечены некоторые общие особенности аритмического синдрома НДСТ:
Учитывая, что по данным многочисленных исследований несбалансированный вегетативный фон, снижение тканевого пула магния имеют место у большинства пациентов с НДСТ, коррекция аритмического синдрома, имея особенности, связанные с вариантом нарушений электрогенеза, должна включать препараты с вегетотропным действием, содержащие значимые макроэлементы (магний). На сегодняшний день известно, что ионы магния участвуют в процессах метаболизма соединительной ткани, контролируют нормальное функционирование кардиомиоцита на всех уровнях субклеточных структур, принимают участие в регуляции сократительной функции миокарда. В то же время внутриклеточный дефицит магния увеличивает активность синусового узла, которая укорачивает время атриовентрикулярного проведения, снижает абсолютную рефрактерность и удлиняет рефрактерность относительную, следствием чего может быть развитие разнообразных нарушений ритма. При этом антиаритмический эффект препаратов магния обусловлен не только ликвидацией внеклеточного электролитного дисбаланса и повышением внутриклеточной концентрации магния и калия, но и активирующим воздействием катионов органических остатков на обменные процессы в миокарде [1].
Мы наблюдали 120 пациентов в возрасте от 18 до 42 лет (средний возраст 30,30 ± 2,12 года, мужчин — 66, женщин — 54) с НДСТ различной степенью выраженности, имеющих деформации грудной клетки (воронкообразную деформацию I степени — 27 человек, 22,5%; II степени — 13 человек, 10,8%; III степени — 6 человек, 5%; килевидную (манубриокостальный тип — 18 пациентов, 15%; корпорокостальный тип — 19 человек, 15,8%; костальный тип — 12 пациентов, 10,0%), астеническую форму грудной клетки (7 пациентов, 5,8%), комбинированные изменения позвоночного столба — 103 пациента, 85,8%); клапанный синдром (ПМК I степени — 96 человек, 80,0%; II степени — 24 человека, 20,0%) с регургитацией (110 пациентов, 91,7%) или без таковой); малая аномалия развития сердца — аномальные хорды левого желудочка (89 пациентов, 74,2%); расширение корня и восходящего отдела аорты — 8 человек (6,7%).
При расспросе большинство пациентов (104 человека, 86,7%) предъявляли жалобы общего характера: на слабость, повышенную утомляемость, снижение работоспособности, ухудшение памяти, снижение концентрации внимания, головокружение, обморочные состояния, головные боли, апатичность, нарушения засыпания и/или чуткий сон, беспокойство, раздражительность, чувство внутреннего напряжения и/или тревогу. Выраженность указанных жалоб, как правило, увеличивалась в периоды интенсивных психоментальных нагрузок, существенно сказываясь на эффективность работы. В субъективном статусе доминирующими по частоте возникновения и выраженности были жалобы со стороны сердечно-сосудистой системы: кардиалгии (76,7%), ощущения «сердечного дискомфорта» (23,3%), сердцебиение (28,3%), перебои в работе сердца (16,7%), головокружение, общая слабость при резком снижении артериального давления в положении ортопное (35,0%). Боли в области сердца, как правило, были колющего характера с локализацией в области верхушки, либо пациенты отмечали неопределенные ощущения «сердечного дискомфорта». Реже пациенты отмечали кратковременные эпизоды сердцебиения, перебоев в работе сердца, проявления ортостатической гипотензии. Достаточно часто указанные жалобы сопровождались чувством нехватки воздуха либо ощущениями затрудненного вдоха.
При обследовании (общеклиническое обследование, эхокардиография, ЭКГ, Холтер-ЭКГ, определение уровня магния в слюне и сыворотке, исследование исходного вегетативного тонуса на основании клинических тестов (А. М. Вейн, 1998), оценки шкалы вегетативных нарушений опросника для выявления и оценки невротических состояний [3]) выявлялся синдром вегето-сосудистой дистонии с преобладанием симпатических влияний (100 человек, 83,3%) или ваготонией (5,8%), метаболическая кардиомиопатия, аритмический синдром, достоверно более низкое содержание магния в ротовой жидкости в сравнении с обследованными практически здоровыми добровольцами (0,561 ммоль/л).
По данным ЭКГ у всех пациентов выявлялись изменения конечной части желудочкового комплекса, которые мы трактовали в аспекте нарушений метаболических процессов в миокарде в рамках метаболической кардиомиопатии: I степень нарушения реполяризации (увеличение амплитуды зубца T V2–4, синдром «TV2 > TV6» и укорочение сегмента ST) выявлялась у 59 пациентов (49,2%); II степень нарушения реполяризации (инверсия зубца Т, смещение сегмента ST V2–V3 вниз от 0,5 до 1,0 мм) — у 48 пациентов (40,0%), III степень нарушений реполяризации определялась реже — в 10,8%.
Нарушения ритма и проводимости, выявляемые при проведении Холтер-ЭКГ, у пациентов были представлены: синусовой тахикардией (76,7%), синусовой аритмией (23,3%), предсердной, желудочковой экстрасистолией (72,5%), АV-блокадой I–II степени (28,3%), эпизодами наджелудочковой тахикардии (6,7%), миграцией водителя ритма (4,2%). Показатели вариабельности сердечного ритма у 41 человека (34,2%) были повышены, у 12 пациентов (10,0%) — снижены, у 67 человек (55,8%) были в пределах нормы. Ригидный ритм наблюдается у 7 (5,8%) пациентов.
Всем пациентам назначался Магнерот по следующей схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 7 недель.
После завершения курса лечения было отмечено статистически достоверное повышение содержания магния как в сыворотке крови (с 0,867 ммоль/л до 0,955 ммоль/л), так и в ротовой жидкости (с 0,561 ммоль/л до 0,903 ммоль/л). Следует отметить, что быстрее повышалось содержание магния в сыворотке крови (через 4 недели лечения), в то время как динамика содержания магния в ротовой жидкости достоверно обнаружилась после завершения полного курса приема препарата «Магнерот». Вероятно, именно уровень магния в ротовой жидкости, как показатель, наиболее надежно отражающий содержание магния в тканях, и следует оценить у пациентов с ДСТ исходно, а также мониторировать в ходе лечебных воздействий.
В целом на фоне лечения выявлялась выраженная положительная динамика по таким характеристикам физической составляющей качества жизни, как утомляемость (частота выявления симптома до и после лечения, соответственно — 87,5% (105/120) и 28,3% (34/120), McNemar r 2 6,61; р = 0,01) снижение работоспособности (соответственно 48,3% (58/120) и 6,7% (8/120), McNemar χ 2 39,19; р = 0,000), потеря интереса к жизни (соответственно 27,5% (33/120) и 5,0% (6/120) McNemar r 2 66,86; р = 0,000). Показатели вариабельности сердечного ритма после лечения оказались в пределах нормы у 66,7% (80/120) пациентов (исходно — 44,2%; McNemar χ 2 5,90; р = 0,015). Было отмечено достоверное изменение показателя шкалы вегетативных нарушений (-2,35 и 1,28, соответственно до и после лечения), отражающее снижение вегетативной напряженности.
Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости метаболических нарушений процессов реполяризации I степени (McNemar χ 2 14,27; р = 0,0002) и II степени (McNemar χ 2 10,09; р = 0,002), синусовой тахикардии (McNemar r 2 12,69; р = 0,000), синусовой аритмии (McNemar χ 2 4,22; р = 0,04), экстрасистолии (McNemar r 2 9,60; р = 0,002) (табл. 3).
В ходе исследования среди пациентов не было отмечено каких-либо жалоб, связанных с проводимой терапией.
Следует отметить, что снижение частоты выявления наиболее часто регистрируемых нарушений ритма, связанных как с нарушением автоматизма синусового узла, так и с активацией латентных очагов, наблюдалось на фоне коррекции вегетативных нарушений, улучшения электрофизиологических характеристик метаболизма миокарда и повышения содержания магния в тканях.
Таким образом, препарат «Магнерот» при НДСТ хорошо переносится, уменьшает вегетативную дисрегуляцию, клинические проявления метаболической кардиомиопатии, корректирует синусовые нарушения ритма, снижает частоту регистрации активных эктопических комплексов, а также позитивно влияет на физическую трудоспособность. Применение комплексных программ реабилитации с включением препаратов магния (Магнерот) для коррекции клинических проявлений аритмического синдрома на фоне метаболической кардиомиопатии и вегетативного дисбаланса патогенетически оправдано и эффективно.