токсокароз код по мкб 10 у детей
ТОКСОКАРОЗ: современный подход
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Токсокароз у детей: эпидемиологические, клинические и лабораторные аспекты
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Цель исследования: оптимизация диагностики токсокароза на основе анализа эпидемиологических, клинических и лабораторных показателей у детей с инвазией.
Материал и методы: проведен анализ данных официальной статистической отчетности за период 2014–2018 гг., данных литературы, ретроспективный анализ 57 медицинских карт больных (40 детей и 17 взрослых), получавших лечебно-диагностическую помощь в клинике инфекционных и паразитарных болезней ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора в 2015–2018 гг.
Результаты исследования: отмечено снижение частоты впервые выявленных случаев инвазии, зарегистрированных в клинике ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора, что коррелирует с данными официальной статистики (r=0,9; р=0,05). На основании данных клинического и лабораторного обследования диагноз был установлен 26 (45,6%) пациентам. Среди пациентов с верифицированным диагнозом токсокароза доля детей в возрасте от 1 года 1 мес. до 10 лет составила 96%. Анализ эпидемиологических данных показал, что 76% детей имели тесный контакт с почвой. У 36% пациентов инвазия протекала в форме скрытого токсокароза. Более чем в половине наблюдений (56%) заболевание клинически проявлялось геофагией. Постоянным лабораторным показателем у пациентов с токсокарозом была лейкемоидная реакция эозинофильного типа. Эозинофилия периферической крови варьировала от 15,7±9,31% при скрытом токсокарозе до 25,5±15,0% — при висцеральном. Коэффициент позитивности (КП) в иммуноферментном анализе (ИФА) с токсокарозным антигеном был выше в группе пациентов с висцеральным токсокарозом, однако корреляции между уровнем эозинофилии и КП не установлено (r=0,1; р=0,05).
Заключение: для своевременной диагностики инвазии у детей на территориях, где регистрируется заболеваемость токсокарозом и имеет место высокая контаминация окружающей среды инвазионными яйцами геогельминтов, целесообразно исследование периферической крови, в первую очередь у детского населения, не реже 1 раза в год в осенний период. При выявлении эозинофилии периферической крови показано дальнейшее обследование, в т. ч. c использованием ИФА с токсокарозным антигеном.
Ключевые слова: токсокароз, статистика, заболеваемость, эозинофилия, иммуноферментный анализ, токсокарозный антиген.
Для цитирования: Андреева А.О., Головченко Н.В., Журавлев А.С. Токсокароз у детей: эпидемиологические, клинические и лабораторные аспекты. РМЖ. Медицинское обозрение. 2020;4(9) [принята в печать]. DOI: 10.32364/2587-6821-2020-4-9.
Введение
Токсокароз — зоонозный геогельминтоз, источником которого являются животные семейств псовых и кошачьих, широко распространен во всем мире. Возбудители инвазии — круглые черви рода Toxocara [1]: Toxocara canis, реже Toxocara cati, Toxocara leonina. Человек заражается при употреблении в пищу продуктов, загрязненных почвой, контаминированной инвазионными яйцами данных аскаридат [2].
Первые данные о заболевании токсокарозом человека были представлены в 1950-х гг. [3]. Исследователи описывали случаи обнаружения личинок Toxocara spp. в энуклеированных глазах детей, оперированных в связи с подозрением на ретинобластому [4]. При гистологическом исследовании сетчатки глаз были обнаружены гранулематозные поражения, содержащие личинки Toxocara spp. [3, 4]. В 1952 г. P. Beaver et al. сообщили о серии случаев заболевания детей с одинаковыми клиническими симптомами (лихорадка, эозинофильная реакция, полиорганность поражений) [4]. На основании результатов дальнейших исследований [5–8] авторами были классифицированы следующие клинические формы инвазии: висцеральная, глазная, неврологическая, латентная и распространенный токсокароз, а также нейротоксокароз.
В настоящее время токсокароз остается одной из наиболее сложных медицинских проблем. Многообразие клинических форм, отсутствие достоверных неинвазивных способов диагностики этого гельминтоза являются основными причинами гипо- или гипердиагностики токсокароза [7–9]. Несмотря на относительно доброкачественное течение инвазии (за период ее официальной регистрации не отмечено ни одного летального исхода), токсокароз нередко приводит к осложнениям в форме различных хронических заболеваний, связанных с воздействием возбудителя на иммунную систему человека [10]. Более того, клинически манифестный токсокароз, протекающий с выраженными изменениями показателей периферической крови, требует проведения дифференциальной диагностики с заболеваниями крови, ошибки в выявлении которых могут привести к фатальному исходу.
Одним из наиболее широко применяемых методов диагностики токсокароза на сегодняшний день является твердофазный иммуноферментный анализ (ИФА) с целью определения иммуноглобулинов класса G (IgG) к Toxocara canis. Однако данный метод имеет ряд естественных ограничений, и на территориях, где регистрируется высокая степень контаминации объектов окружающей среды яйцами аскаридат и, соответственно, значительная доля серопозитивных лиц среди условно здорового населения, неверная интерпретация результатов ИФА может привести к диагностическим ошибкам, а значит, неверному выбору тактики ведения больного [11].
Анализ данных литературы последних 5 лет свидетельствует о том, что в настоящее время недостаточно внимания уделяется вопросам диагностики, лечения и профилактики токсокароза.
Цель исследования: оптимизация диагностики токсокароза на основе анализа эпидемиологических, клинических и лабораторных показателей.
Материал и методы
Материалом для настоящей работы явились данные официальной статистической отчетности за период 2014–2018 гг., материалы Государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году» [12]. Проведен ретроспективный анализ 57 медицинских карт больных (40 детей и 17 взрослых), получавших лечебно-диагностическую помощь в клинике инфекционных и паразитарных болезней ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора в 2015–2018 гг. Критерием включения в исследование был направительный диагноз «токсокароз».
Всем больным проводилось стандартное обследование в соответствии с общепринятой клинической практикой: общий анализ крови, общий анализ мочи, биохимические тесты функции печени, поджелудочной железы. Кроме того, с целью исключения других паразитарных инвазий выполнялись исследования биологического материала специальными методами обогащения в соответствии с Методическими указаниями [13]. Для серологической диагностики токсокароза использовали ИФА с целью выявления специфических IgG к Toxocara canis с помощью диагностической тест-системы «Токсокар-IgG-ИФА-БЕСТ» производства ЗАО «Вектор-Бест» в соответствии с Методическими указаниями [14].
Статистическую обработку полученных данных проводили с использованием программ Microsoft Excel 2010 и Statistica 6.0. Использовали метод корреляции Пирсона (r), непараметрический критерий Крускала — Уоллиса. Статистически значимым считали результат при t>2, при котором р=0,05.
Результаты
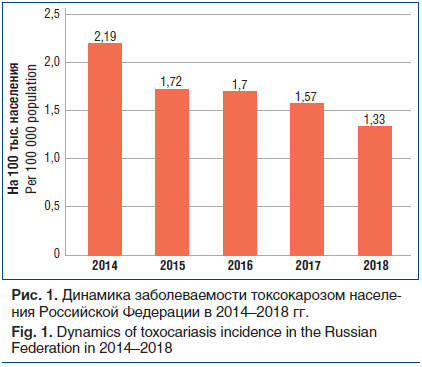
По данным официальной статистической отчетности [15–18], в последние годы отмечается снижение заболеваемости токсокарозом населения Российской Федерации (рис. 1).
В 2018 г. данный показатель составил 1,33 на 100 тыс. населения, что в 1,6 раза ниже, чем в 2014 г. По данным Государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году», в структуре больных токсокарозом доля детского населения в возрасте от 0 до 17 лет составила 35%, доля сельских жителей — 43,7%, из них детей — 35,3% [12].
При обследовании по месту жительства у всех 57 проанализированных нами больных были положительные результаты ИФА с токсокарозным антигеном, однако диагноз «токсокароз» был верифицирован в 26 случаях (у одного взрослого и 25 детей). Окончательный диагноз устанавливали на основании клинических и лабораторных данных: геофагии, эозинофилии, лейкоцитоза и анемии периферической крови, положительного результата ИФА с токсокарозным антигеном с учетом эпидемиологического анамнеза. У остальных пациентов были диагностированы другие заболевания, в т. ч. паразитарные инвазии.
Динамика числа случаев верифицированного токсокароза в клинике РостовНИИ микробиологии и паразитологии Роспотребнадзора свидетельствует о снижении числа впервые выявленной инвазии по годам: 12 случаев токсокароза в 2016 г., 9 случаев в 2017 г. и 4 случая в 2018 г., что коррелирует с данными официальной статистики (r=0,9; р=0,05).
Среди пациентов с верифицированным диагнозом «токсокароз» доля детей в возрасте от 1 года 1 мес. до 10 лет составила 96% (рис. 2). Принимая во внимание, что токсокароз был диагностирован только у 1 взрослого пациента, его исключили из исследования.
Анализ возрастной структуры больных токсокарозом свидетельствует о том, что наиболее часто подвержены инвазии дети младшего дошкольного возраста. Доля больных токсокарозом в возрасте от 2 лет до 5 лет 11 мес. составила 68%.
Анализ данных эпидемиологического анамнеза показал, что 13 (52%) детей были жителями сельской местности, проживали в домах с приусадебными участками и домашними животными (собаками, кошками). В городе проживали 12 (48%) человек, однако из них 3 ребенка в летнее время постоянно находились у родственников в деревне, а еще трое проживали в условиях частных домовладений в Ростове-на-Дону, Таганроге и Новочеркасске. Таким образом, тесный контакт с почвой наблюдался у 19 (76%) человек.
Из медицинских карт больных установлено, что выраженные клинические проявления регистрировались у 16 (64%) пациентов, 9 (36%) детей были выявлены по месту жительства при плановой диспансеризации в связи с обнаружением эозинофилии в периферической крови. Таким образом, в соответствии с клиническими формами инвазии были определены две группы больных: со скрытым и манифестным висцеральным токсокарозом.
Анализ результатов лабораторного обследования показал, что лейкоцитоз, анемия и лейкемоидая реакция эозинофильного типа регистрировались у всех больных. Коэффициент позитивности (КП) в ИФА с токсокарозным антигеном был выше 7 (табл. 1). Статистический анализ результатов лабораторного обследования детей показал отсутствие значимых различий в группах со скрытым и клинически манифестным токсокарозом (непараметрический критерий Крускала — Уоллиса: 0,696).
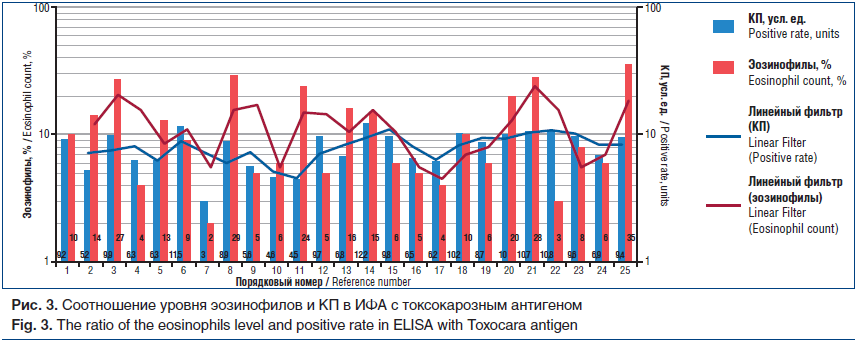
Следует отметить, что корреляции между уровнем эозинофилов и КП в ИФА с токсокарозным антигеном также не установлено (r=0,1; р=0,05; рис. 3).
Данные медицинских карт показали, что выраженная геофагия отмечалась у 14 детей с висцеральной формой заболевания, также в данной группе у 7 (28%) детей регистрировалась лихорадка, у 3 (12%) — уртикарная сыпь, у 3 (12%) — лимфаденопатия, у 4 (16%) — диспепсические явления (боли в животе, тошнота, снижение аппетита).
Обсуждение
В отличие от большинства зарубежных стран [19] в Российской Федерации токсокароз подлежит обязательной регистрации, а о каждом случае заболевания информация поступает в органы Роспотребнадзора, что позволяет иметь относительно полное представление о заболеваемости данной инвазией в субъектах Российской Федерации.
Результаты нашего исследования свидетельствуют в пользу улучшения эпидемиологической ситуации по токсокарозу и соответствуют как данным официальной статистической отчетности, Государственного доклада Роспотребнадзора «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году», так и данным литературы [20]. Однако в отличие от федеральной статистической отчетности и результатов исследования ряда ученых, позиционирующих токсокароз как урбанистическую патологию преимущественно взрослого населения [17, 19, 21], по нашим данным, на юге России инвазии подвержены в первую очередь дети раннего возраста до 4 лет (52%),проживающие в условиях частных домовладений (76%). Такое несоответствие может быть связано с отсутствием надежных методов лабораторной диагностики инвазии, что приводит к гипердиагностике токсокароза у взрослого населения и гиподиагностике у детей, среди которых инвазия нередко протекает бессимптомно (по нашим данным, в 36% случаев). В регионах, где почва контаминирована яйцами токсокар, регистрируется значительная доля серопозитивных в отношении IgG к Toxocara canis среди условно здорового населения, что является одной из причин гипердиагностики токсокароза [9]. Положительный результат ИФА с токсокарозным антигеном регистрируется также у больных, страдающих аллергиями и другими паразитарными болезнями [22, 23]. Это соответствует полученным нами данным: из 57 больных с положительным результатом ИФА у 54,4% были верифицированы иные паразитарные или системные болезни.
Одним из наиболее постоянных неспецифических признаков глистной инвазии является эозинофилия [24]. По нашим данным, этот показатель при токсокарозе у детей варьировал от 15,6±9,31% при скрытом токсокарозе до 25,5±15,0% при висцеральном. В некоторых случаях эозинофилия превышала 60%, что в сочетании с лейкоцитозом, анемией и ускоренной СОЭ требовало дифференциальной диагностики с заболеваниями крови. В таких клинических ситуациях серологические исследования с целью выявления специфических иммуноглобулинов к Toxocara canis играли важную роль в обосновании клинического диагноза.
Заключение
Несмотря на положительную динамику эпидемиологической ситуации, токсокароз на сегодняшний день остается социально значимой проблемой здравоохранения. Это обусловлено многообразием клинических проявлений и форм, отсутствием патогномоничных признаков инвазии и достоверных методов специфической диагностики, вследствие чего имеют место ошибки и поздняя диагностика заболевания. Для своевременной диагностики инвазии у детей на территориях, где регистрируются заболеваемость токсокарозом и высокая контаминация окружающей среды инвазионными яйцами геогельминтов, целесообразно исследование периферической крови, в первую очередь у детского населения, не реже 1 раза в год в осенний период. При выявлении эозинофилии периферической крови показано дальнейшее обследование с применением чувствительных и специфичных методов, в т. ч. ИФА с токсокарозным антигеном.
Сведения об авторах:
1 Андреева Анна Олеговна — врач-инфекционист клиники инфекционных и паразитарных болезней, ORCID iD 0000-0001-5299-0737;
1 Головченко Наталья Владимировна — врач клинической лабораторной диагностики клиники инфекционных и паразитарных болезней, ORCID iD 0000-0002-3683-1776;
2 Журавлев Андрей Сергеевич — студент Центра инновационных образовательных программ «Медицина будущего», ORCID iD 0000-0002-9130-707X.
1 ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора. 344000, Россия, г. Ростов-на-Дону, пер. Газетный, д. 119.
2 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2