определение понятия биологического кода
66. Понятие о биологическом коде, свойства биологического кода.
Универсальность биологического кода и процессов биосинтеза белка.
Триплетность и наличие
Каждый триплет кодирует только одну аминокислоту
Одну аминокислоту могут кодировать несколько триплетов (от 2 до 6)
Почти у всех видов организмов биологический код одинаков
Информация, записанная в зрелой мРНК в виде линейной последовательности кодонов (триплетов), считывается в направлении от 5′- к 3′-концу
Последовательность кодонов в зрелой мРНК соответствует последовательности аминокислот в синтезированном белке
67. Транспортная рнк как адаптор аминокислот. Биосинтез аминоацил-т-рнк.
Второй тип РНК называют транспортной (адапторной сокращенно— т-РНК). Она выполняет функцию переносчика активированных аминокислотк месту синтеза белка. Каждая молекула такой РНК является адаптером только какой-нибудь одной аминокислоты, т. е. находит место аминокислоты на и-РНК- Поэтому в клетке имеется не менее 20 разновидностей РНК, специализированных для 20 аминокислот.
68. Субстратная специфичность арс-аз, их роль. Изоакцепторные т-рнк.
Реакция аминоацилирования осуществляется ферментами аминоацил-тРНК-синтетазами, способными узнавать три различных субстрата: АТФ, аминокислоту и тРНК. В активном центре молекулы фермента осуществляются активация аминокислоты и присоединение ее к концевому остатку рибозы тРНК. Для каждой аминокислоты в клетке имеется аминоацил-тРНК-синтетаза (АРСаза), способная отличать свою аминокислоту от остальных, часто очень похожих по структуре/
Аминоацил-тРНК-синтетазы осуществляют присоединение аминокислоты к молекуле транспортной РНК, что является ключевым моментом в реализации генетической информации.
Биологический код, его свойства, значение в биосинтезе белка. Взаимодействие кодонов с антикодонами
Таблица 3.5. Свойства биологического кода
Таблица 3.6. Основные компоненты белок-синтезирующей системы и их функции в процессе трансляции
Взаимодействие кодона и антикодона
Большинство молекул тРНК спаривается более чем с одним кодоном. Поскольку кодоны транслируются при участии антикодонов разных тРНК, можно было бы ожидать, что для каждого из 61 кодона, детерминирующего аминокислоты, имеется своя тРНК. Однако не существует ни разных тРНК для каждого из четырех валиновых или глициновых кодонов, ни разных тРНК для обоих тирозиновых или обоих лизиновых кодонов. Действительно, эксперименты in vitro и in vivo показали, что некоторые тРНК могут транслировать более чем один кодон. Так, кодоны UAU и UAC транслирует единственная тРНКТуг. Поскольку антикодон этой тРНКТуг имеет последовательность 5′-GUA-3′, он может образовать комплементарные пары с первыми двумя основаниями любого из этих кодонов. Соответственно G способен спариваться как с U, так и с С, находящимися в третьем положении кодонов; аналогичным образом U, находясь на 5′-конце какого-либо антикодона, может спариться и с А, и с G, находящимися на 3′-конце соответствующих кодонов. На самом деле трансляция всех пар кодонов, у которых в третьей позиции стоит U или С, может осуществляться одной и той же тРНК, у которой первым основанием в антикодоне оказывается G или какое-то модифицированное основание. По-видимому, при спаривании кодонов и антикодонов в А- и Р-участках включаются какие-то стабилизирующие взаимодействия, отличные от тех, которые имеют место при обычном комплементарном спаривании оснований. www.titaniumbank.ru
Анализ генетического кода показывает, однако, что существуют специфические взаимодействия, позволяющие различать кодоны, у которых в третьей позиции стоит А или G. Например, тРНК, расшифровывающая кодон AUG как метионин, должна отличать этот триплет от кодона AUA, обозначающего изолейцин, а тРНК’1*11′ должна отличать триптофановый кодон UGG от терминирующего кодона UGA. Специфичность обеих этих операций декодирования определяется спариванием С антикодона с G, находящимся в третьем положении кодона.
Модификация оснований в антикодонах может еще сильнее ограничить диапазон возможных взаимодействий кодон-антикодон. Например, гипоксантин, занимая место аденина в той позиции антикодона, по которой происходит спаривание с третьим основанием кодона, может обусловить спаривание такого антикодона с кодонами, у которых в последней позиции стоят основания U, С или А. Разнообразие модификаций оснований в антикодо-нах или–что встречается наиболее часто – оснований, соседствующих с антикодоном, изменяет специфичность взаимодействия аминоацил-тРНК–кодон. Таким способом обычно предотвращаются ошибки при считывании третьего основания кодонов и обеспечивается надежность процесса декодирования.
Правила спаривания оснований, согласно которым молекулы тРНК одного типа могут узнавать несколько разных кодонов, называются правилами неоднозначного соответствия. Следует отметить, однако, что термин «качание», используемый для описания некоторой свободы спаривания третьего основания кодона, просто как бы затушевывает тот факт, что мы до конца не знаем, какие именно химические и структурные особенности обусловливают кодон-антикодоновые взаимодействия в Р-и А-участках рибосомы.
Мутации в кодонах и антикодонах. Мутации, затрагивающие различные компоненты трансляционного аппарата, могут изменить результат считывания кодирующей последовательности. Наиболее драматичные последствия вызывают те мутации в гене, кодирующем белок, которые превращают кодон, отвечающий какой-то аминокислоте, в терминирующий кодон и тем самым приводят к преждевременному завершению синтеза из-за досрочной терминации трансляции в мутировавшем сайте. Примером может служить превращение лизинового кодона ААА в UAA и глутаминового кодона CAG в UAG. Аналогично любая мутация, в результате которой происходит замена аминокислотного кодона на кодон UGA, тоже вызовет преждевременную остановку синтеза полипептидной цепи. Однако, если в результате второй мутации произойдет изменение соответствующего основания в антикодоне тРНК, терминация может быть предотвращена, или супрессирована, и образуется полноразмерный, хотя и измененный, белок. Например, если тРНК, тРНК или тРНК изменятся подобным образом, то они смогут прочитать кодон UAG как аминокислотный. С помощью различных механизмов может произойти ошибочная трансляция и таких мутантных кодонов, как UAA и UGA. Мутации в тРНК-генах, затрагивающие основания, отличные от тех, которые составляют антикодон, могут привести к изменению специфичности или стабильности взаимодействий кодона и антикодона. Благодаря таким механизмам может быть предотвращена преждевременная терминация синтеза полипептида, если терминирующий кодон будет прочитан как смысловой. Подобная супрессия терминации, как правило, не очень эффективна, поэтому наряду с полноразмерными образуются и укороченные, преждевременно терминированные полипептидные цепи. Благодаря относительной неэффективности такой трансляционной супрессии не приносит большого вреда и случайное проскакивание терминирующих кодонов, находящихся на естественных концах кодирующих мРНК.
25) Понятие о катаболизме и анаболизме и их взаимосвязи. Эндергонические и экзергонические реакции
Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Он выполняет три специализированные функции:
1. Энергетическая – снабжение клетки химической энергией,
2. Пластическая – синтез макромолекул как строительных блоков,
3. Специфическая – синтез и распад биомолекул, необходимых для выполнения специфических клеточных функций.
Анаболизм – это биосинтез белков, полисахаридов, липидов, нуклеиновых кислот и других макромолекул из малых молекул-предшественников. Поскольку он сопровождается усложнением структуры, то требует затрат энергии (эндергонические реакции). Источником такой энергии является энергия АТФ. Также для биосинтеза некоторых веществ (жирные кислоты, холестерол) требуются богатые энергией атомы водорода – их источником является НАДФН. Молекулы НАДФН образуются в реакциях окисления глюкозо-6-фосфата в пентозном пути и оксалоацетата малик-ферментом. В реакциях анаболизма НАДФН передает свои атомы Н2на синтетические реакции и окисляется до НАДФ. Так формируется НАДФ-НАДФН-цикл.
Весь катаболизм условно подразделяется на три этапа:
I этап. Специфический. Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.
II этап.Специфический. Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ.
III этап.Общий, неспецефический. Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием «окислительное фосфорилирование» образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
Окислительно-восстановительными называются такие реакции, в процессе которых
происходит перенос электронов от восстановителя к окислителю. Существует четыре способа передачи электронов от одной молекулы к другой: 1. Прямой перенос электронов.2. Перенос электрона в составе атома водорода.3. Перенос двух электронов в составе гидрид-иона.4. Перенос электронов на О2путем присоединения оного к молекуле-восстановителю.
окислительно-восстановительным потенциалом (Е0). Величину окислительно-восстановительного потенциала (в вольтах) конкретной окислительно-восстановительной пары определяют путем сравнения со стандартом. Чем выше величина стандартного окислительно-восстановительного потенциала некоторой окислительно-восстановительной пары, тем выше способность этой пары принимать электроны. Поток электронов всегда направлен таким образом, чтобы в результате свободная энергия системы уменьшалась. Е, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ. Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют
. Существует три основных способа использования АТФ:
2)транспорт веществ через мембраны,
3)изменение формы клетки и ее движение.
Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл.
Биологический код
Биосинтез белков, или трансляция, отличается от биосинтеза ДНК и РНК (репликации ДНК и трансляции РНК) двумя принципиальными особенностями: между мРНК (матрицей) и пептидной цепью белка, которая на этой матрице синтезируется, нет комплементарного соответствия, т.е. структура рибонуклеотидов (мономеров матрицы) и аминокислот (мономеров белка) такова, что избирательные взаимодействия между ними, подобные образованию пар А…Т или Г…Ц, невозможны, нет соответствия между числом мономеров – нуклеотидов в матрице и в продукте реакции (в мРНК 4 разных нуклеотида, в белке 20 разных аминокислот);
Поэтому механизм использования матрицы при биосинтезе белка отличается от использования матриц при репликации и транскрипции.
Способ записи информации о первичной структуре белков в нуклеиновых кислотах получил название биологического кода (его также называют генетическим, нуклеотидным, аминокислотным кодом).
Один из первых вопросов, который возникает при выяснении структуры биологического кода, – это вопрос о кодовом числе; т.е. о числе нуклеотидных остатков, кодирующих включение в белок одной аминокислоты. Очевидно, что кодовое число не может быть равным единице, так как в этом случае с помощью четырех нуклеотидов можно было бы закодировать только четыре аминокислоты. При кодовом числе 2 количество разных нуклеотидных пар будет равно числу перестановок из четырех элементов по 2, т.е равно 4 2 = 16, что тоже недостаточно для кодирования всех аминокислот. Число разных троек нуклеотидов равно 4 3 = 64. Это в три с лишним раза превышает минимальное число необходимое для кодирования 20 аминокислот. Экспериментально доказано, что в биологическом коде кодовое число равно трем: тройку нуклеотидных остатков (триплет), кодирующих включение одной аминокислоты, называют кодоном.
Из 64 кодонов (триплетов), (табл.1) 61 используется для кодирования аминокислот, а три – УАА, УAГ и УГA – обозначают конец матрицы: на этих триплетах обрывается дальнейшее наращивание пептидной цепи – терминирующие кодоны. Каждый триплет кодирует только какую-нибудь одну аминокислоту. Это свойство кода называют специфичностью. С другой стороны, одна аминокислота может кодироваться двумя или большим числом (до шести) разных триплетов, т.е. код вырожденный, но первые два нуклеотида для данной аминокислоты всегда одинаковы. Непрерывность кода белкового синтеза состоит в том, что все входящие в его состав кодоны располагаются в мРНК, кодирующей биосинтез определенного белка, в строгом порядке один возле другого, не будучи разделенными иными моно- или олигонуклеотидными вставками. Неперекрывающийся характер кода заключается в том, что ни один из нуклеотидов одного кодона не является составной частью другого (соседнего) кодона.
К настоящему времени биологический код изучен у всех биологических объектов (от вирусов и бактерий до высших животных). Во всех случаях он оказался одинаковым. Эта универсальность кода свидетельствует о единстве происхождения всех форм жизни на Земле.
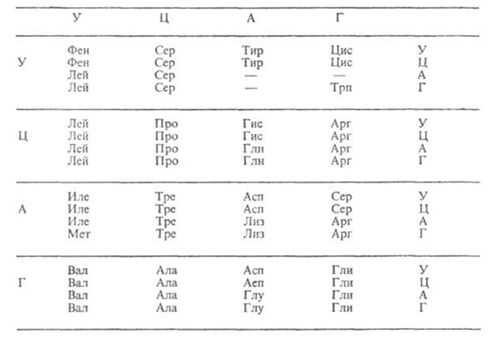
Таблица 1 – Биологический код
| У | Ц | A | Г | ||||
| Первая буква | У | 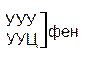 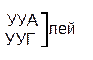 | 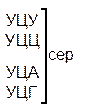 | 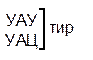 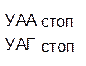 | 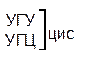 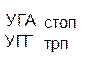 | У Ц А Г | Третья буква |
| Ц | 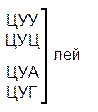 | 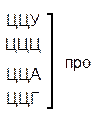 | 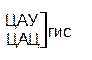 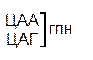 | 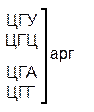 |  У Ц А Г У Ц А Г | ||
| A | 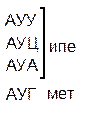 | 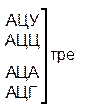 | 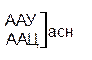 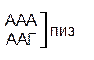 | 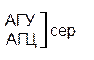 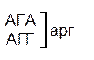 | У Ц А Г | ||
| Г | 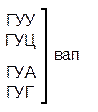 | 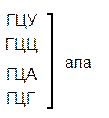 | 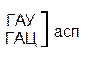 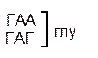 | 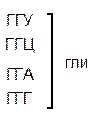 | У Ц А Г |
Генетический код, состоящий из 64 триплетов – оснований (кодонов) и соответствующих им аминокислот
3.4 Схема передачи генетической информации
от ДНК к белку
Допустим, что на определенном участке одной из спиралей молекулы ДНК, на которой синтезируется мРНК, мы имеем определенную последовательность нуклеотидов. Синтезированная на этом участке мРНК может иметь лишь строго определенную, комплементарную ДНК последовательность нуклеотидов (учитывая, что урацил РНК соответствует тимину ДНК). «Считывая» нуклеотидный код мРНК справа налево (от N-конца полипептида к С-концу), получим определенную последовательность аминокислот в данном полипептиде, который может синтезироваться под генетическим контролем этого участка молекулы ДНК.
Перенос информации от ДНК к белку можно изобразить в виде схемы:
| ДНК | Г А А | | | | | | ЦТ Т | А Ц Т | | | | | | Т Г A | Ц Г Г | | | | | | Г Ц Ц | A T T | | | | | | Т A A | – …Нетранскрибируемая цепь …Кодоны ДНК |
| мРНК | | | | Г А А | | | | А Ц У | | | | Ц Г Г | | | | A У У | …Кодоны мРНК |
| Белок | Глутами-новая кислота | Треонин | Аргинин | Изолейцин | …Аминокислотная последовательность |
3.5 Биосинтез белков – трансляция
Сборка полипептидной цепи белка из составляющих ее аминокислот включает четыре стадии: активацию и отбор аминокислот; инициацию синтеза полипептидной цепи; элонгоцию (удлинение) полипептидной цепи; терминацию синтеза полипептидной цепи.
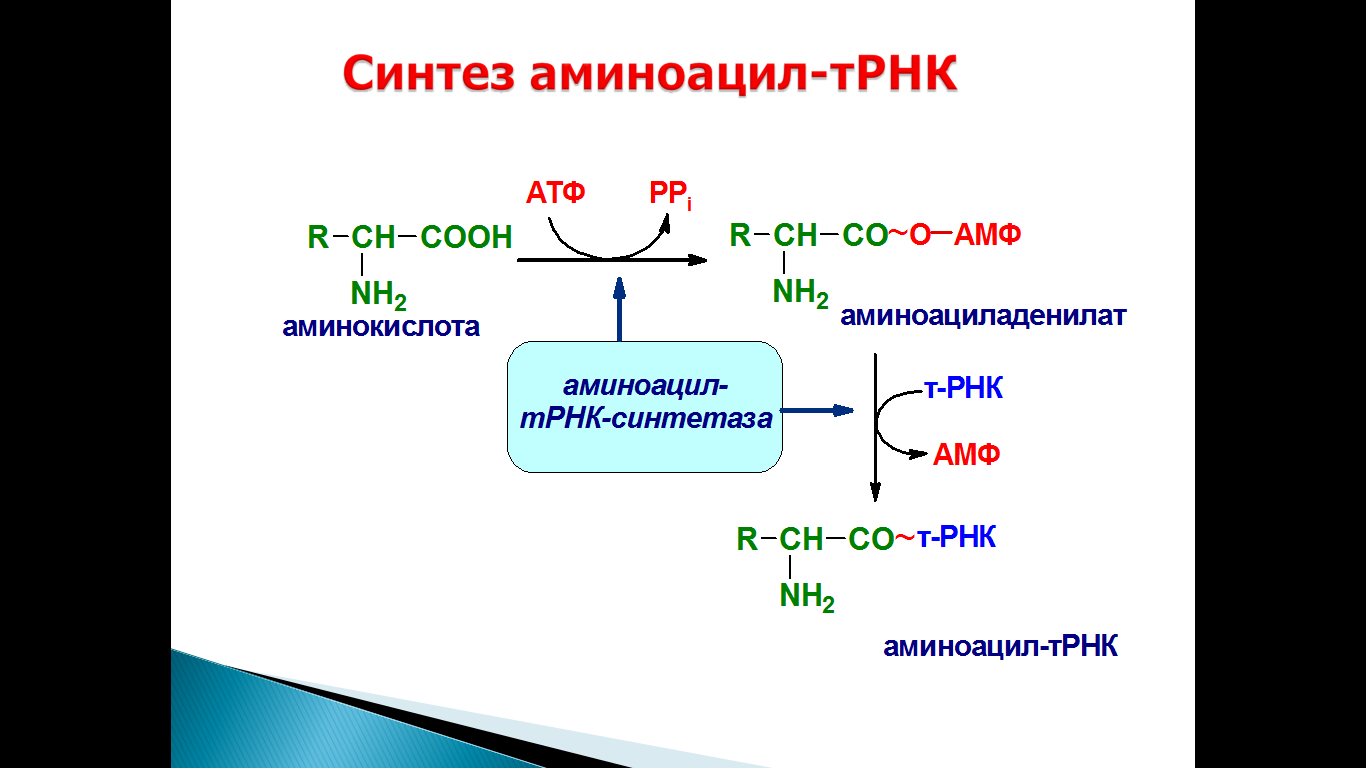
Первая стадия – активация – это превращение аминокислоты в аминоацил – тРНК.
Взаимодействие тРНК с аминокислотами – ферментативный процесс, приводящий к образованию ковалентной сложноэфирной связи между аминокислотой и тРНК.
Аминокислота + АТФ + т РНК–––––® Аминоацил – тРНК + АМФ+ Н4Р2О7
Известно не менее двадцати различных аминоацил – тРНК – синтетаз, каждая из которых катализирует реакцию только одной из 20 аминокислот с тРНК, соответствующей этой аминокислоте. Каждая синтетаза высокоспецифична, в ее активном центре находится участок, комплементарный какой-то части молекулы одной из тРНК. Это позволяет каждой синтетазе соединять определенную аминокислоту с соответствующей тРНК.
Вторая стадия синтеза белка – инициация –начинается с образования инициирующего комплекса.
Поступившая из ядра в цитоплазму мРНК соединяется с малой (40 S) субъединицей рибосомы и инициирующим ей аминоацилом – тРНК. Затем к этому комплексу присоединяется большая (60 S) субъединица рибосомы.
Инициирующий аминоацил – тРНК – содержит аминокислоту метионин – Меt – тРНК. В дальнейшем Меt – тРНК взаимодействует своим триплетом нуклеотидов, комплементарным кодом АУГ или ЦУЦ на мРНК. Эти два кодона на мРНК называют инициирующими. С одного из них начинается синтез любого белка.
Третья стадия – элонгация. Процесс элонгации начинается со связывания аминоацил – тРНК – с инициирующим комплексом, соответствующим первому кодону мРНК, следующему за инициирующим кодоном. Кодон мРНК должен спариваться с антикодоном, т.е. с таким триплетом в молекуле тРНК, который комплементарно ему соответствует. Эта тРНК взаимодействует затем не только с мРНК, но и с определенными участками рибосомы – центрами связывания – пептидильным (донорным) и акцепторным. В процессе связывания аминоацила – тРНК– расходуется одна молекула ГTФ. Затем начинается образование пептидной связи между инициаторным метионином из Меt-тРНК и первой в будущей полипептидной цепи аминокислотой, включенной в аминоацил-тРНК. Образовавшийся дипептидил – тРНК – связан с кодоном, соответствующим аминокислоте, и центром связывания рибосомы.
Затем происходит транслокация – перемещение рибосомы относительно мРНК и дипептидил-тРНК. В результате этого перемещения дипептидил-тРНК оказывается в пептидильном центре рибосомы, а тРНК метионина освобождается из комплекса. На транслокацию расходуется две молекулы ГTФ.
Дальнейшее удлинение пептидной цепи происходит путем повторения этих фаз, но теперь уже присоединяется аминоацетил-тРНК, соответствующий второму коноду мРНК, в результате чего образуется трипептид и т.д.(рис 3):
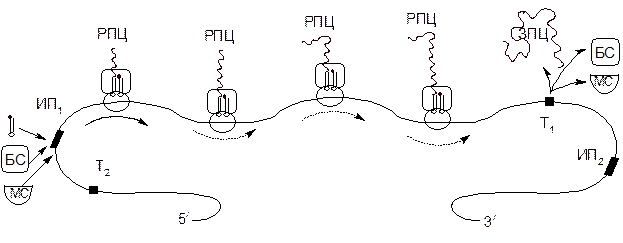
Рисунок 3 – Схема действия полирибосомы, состоящей из четырех рибосом
МС– малая субчастица рибосомы (40S); БС – большая частица рибосомы (60S); РПЦ и ЗПЦ – растущая и завершенная полипептидные цепи; ИП1 и ИП2 – кодоны – инициаторы и участок, узнаваемый рРНК; Т1 и Т2 – кодоны–терминаторы, прерывающие синтез белка.
Остаток аминокислоты инициаторного метионина, участвовавший в стадии инициации и занимающий в растущей пептидной цепи N-концевое положение, отщепляется в стадии элонгации.
Следует отметить, что метионин, встраиваемый не в начало цепи (инициаторный метионин), а внутри – переносится другой тРНК.
Четвертая стадия – терминация. Удлинение пептидной цепи продолжается до тех пор, пока на пути рибосомы не встретится один из терминальных триплетов мРНК. Это триплеты УAA, УAГ или УГA, сигнализирующие окончание синтеза полипептидной цепи. В узнавании этих терминальных конодов участвуют внерибосомные белки – факторы терминации или факторы высвобождения белка, под действием которых происходит гидролитическое расщепление связи между полипептидом и последней тРНК, и высвобождается полипептидная цепь готового белка. После освобождения полипептидной цепи фактор высвобождения, а также мРНК диссоциируют. У растений обнаружен лишь один фактор.
Вторичная и третичная структуры белков формируются в процессе трансляции по мере удлинения пептидной цепи. Как уже отмечалось в разделе «Белки», пространственные структуры белковой молекулы определяются первичной структурой ее полипептидной цепи. В результате формирования вторичной и третичной структур образуются активные центры белков.
В то же время в процессе трансляции и после ее завершения не всегда формируется биологически активный белок. В ряде случаев сформированные молекулы белков-ферментов неактивны, и переход их в активную форму возможен после отщепления части полипептидной цепи путем частичного гидролиза. Так, например, в созревающих семенах ферменты протеазы синтезируются в неактивной форме, они не способны гидролизовать собственные запасные белки до прохождения частичного гидролиза полипептидной цепи молекулы фермента. Только после частичного гидролиза, в результате которого отщепляются трипептид, протеаза переходит в активную форму и начинает гидролизовать запасные белки семян. Продукты гидролиза белков поступают в прорастающий зародыш семени.
Присоединение к молекуле белка простетической группы – кофермента или металла, объединение олигомерных белков в четвертичную структуру также происходят уже после завершения процесса трансляции. В некоторых белках после завершения синтеза полипептидной цепи происходит модификация аминокислотных остатков, например, присоединение дополнительных метильных групп, йодирование, окисление двух остатков цистеина с образованием дисульфидного мостика, гидроксилирование остатков пролина, присоединение сахаров к остатку аспарагина при образовании гликопротеинов, фосфорилирование гидроксильных групп серина или тирозина у некоторых ферментов, присоединение КоА в ацилпереносящем белке синтетазы жирных кислот.
В реальной живой клетке синтез белков протекает не на одной рибосоме, а на комплексе или кластере рибосом – полисоме. Каждая стадия трансляции (инициация, элонгация и терминация) осуществляется каждой рибосомой. Обычно кластеры содержат от 3 до 20 рибосом, но очень большие молекулы мРНК, состоящие из тысяч нуклеотидов, могут образовывать комплексы, содержащие от 50 до 100 рибосом. Скорость синтеза полипептида очень высока: синтез пептида из 100 аминокислот занимает около 2 минут.
Общая схема процесса синтеза белка может быть представлена в следующем виде:
32. Клетка как биологическая система  Читать 0 мин.
Читать 0 мин.
32.275. Генетический код и его свойства
Ранее мы подчёркивали, что нуклеотиды имеют важную для формирования жизни на Земле особенность ― при наличии в растворе одной полинуклеотидной цепочки спонтанно происходит процесс образования второй (параллельной) цепочки на основании комплементарного соединения родственных нуклеотидов. Одинаковое число нуклеотидов, в обоих цепочках и их химическое родство, является непременным условием для осуществления такого рода реакций. Однако при синтезе белка, когда информация с иРНК реализуется в структуру белка никакой речи о соблюдении принципа комплементарности идти не может. Это связано с тем, что в иРНК, и в синтезированном белке различно не только число мономеров, но и, что особенно важно, отсутствует структурное сходство между ними (с одной стороны нуклеотиды, с другой аминокислоты). Понятно, что в этом случае возникает необходимость создания нового принципа точного перевода информации с полинуклеотида в структуру полипептида. В эволюции такой принцип был создан и в его основу был заложен генетический код.
Генетический код ― это система записи наследственной информации в молекулах нуклеиновых кислот, основанная на определённом чередовании последовательностей нуклеотидов в ДНК или РНК, образующих кодоны, соответствующие аминокислотам в белке.
Генетический код имеет несколько свойств:
Следует отметить, что некоторые авторы предлагают ещё и другие свойства кода, связанные с химическими особенностями входящих в код нуклеотидов или с частотой встречаемости отдельных аминокислот в белках организма и т.д. Однако эти свойство вытекают из вышеперечисленных, поэтому там мы их и рассмотрим.
Генетический код, как и многое сложно организованные система имеет наименьшую структурную и наименьшую функциональную единицу. Триплет ― наименьшая структурная единица генетического кода. Состоит она из трёх нуклеотидов. Кодон ― наименьшая функциональная единица генетического кода. Как правило, кодонами называют триплеты иРНК. В генетическом коде кодон выполняет несколько функций. Во-первых, главная его функция заключается в том, что он кодирует одну аминокислоту. Во-вторых, кодон может не кодировать аминокислоту, но, в этом случае, он выполняет другую функцию (см. далее). Как видно из определения, триплет ― это понятие, которое характеризует элементарную структурную единицу генетического кода (три нуклеотидов). Кодон ― характеризует элементарную смысловую единицу генома ― три нуклеотида определяют присоединение к полипептидной цепочки одной аминокислоты.
Элементарную структурную единицу вначале расшифровали теоретически, а затем её существование подтвердили экспериментально. И действительно, 20 аминокислот невозможно закодировать одним или двумя нуклеотидом т.к. последних всего 4. Три нуклеотида из четырёх дают 43 = 64 варианта, что с избытком перекрывает число имеющихся у живых организмах аминокислот (см.табл. 1).
Представленные в таблице 64 сочетания нуклеотидов имеют две особенности. Во-первых, из 64 вариантов триплетов только 61 являются кодонами и кодируют какую-либо аминокислоту, их называют смысловые кодоны. Три триплета не кодируют.
Таблица 1.
Кодоны информационной РНК и соответствующие им аминокислотыявляются стоп-сигналами, обозначающие конец трансляции. Таких триплетов три ― УАА, УАГ, УГА, их ещё называют «бессмысленные» (нонсенс кодоны). В результате мутации, которая связана с заменой в триплете одного нуклеотида на другой, из смыслового кодона может возникнуть бессмысленный кодон. Такой тип мутации называют нонсенс-мутация. Если такой стоп-сигнал сформировался внутри гена (в его информационной части), то при синтезе белка в этом месте процесс будет постоянно прерываться ― синтезироваться будет только первая (до стоп-сигнала) часть белка. У человека с такой патологией будет ощущаться нехватка белка и возникнут симптомы, связанные с этой нехваткой. Например, такого рода мутация выявлена в гене, кодирующем бета-цепь гемоглобина. Синтезируется укороченная неактивная цепь гемоглобина, которая быстро разрушается. В результате формируется молекула гемоглобина, лишённая бета-цепи. Понятно, что такая молекула вряд ли будет полноценно выполнять свои обязанности. Возникает тяжёлое заболевания, развивающееся по типу гемолитической анемии (бета-ноль талассемия, от греческого слова «Таласа» ― Средиземное море, где эта болезнь впервые обнаружена).
Механизм действия стоп-кодонов отличается от механизма действия смысловых кодонов. Это следует из того, что для всех кодоны, кодирующие аминокислоты, найдены соответствующие тРНК. Для нонсенс-кодонов тРНК не найдены. Следовательно, в процессе остановки синтеза белка тРНК не принимает участие.
Кодон АУГ (у бактерий иногда ГУГ) не только кодируют аминокислоту метионин и валин, но и является инициатором трансляции.
61 из 64 триплетов кодируют 20 аминокислот. Такое трёхразовое превышение числа триплетов над количеством аминокислот позволяет предположить, что в переносе информации могут быть использованы два варианта кодирования. Во-первых, не все 64 кодона могут быть задействованы в кодировании 20 аминокислот, а только 20 и, во-вторых, аминокислоты могут кодироваться несколькими кодонами. Исследования показали, что природа использовала последний вариант.
Код, при котором одна аминокислота кодируется несколькими триплетами, называется вырожденным или избыточным. Почти каждой аминокислоте соответствует несколько кодонов. Так, аминокислота лейцин может кодироваться шестью триплетами — УУА, УУГ, ЦУУ, ЦУЦ, ЦУА, ЦУГ. Валин кодируется четырьмя триплетами, фенилаланин — двумя и только триптофан и метионин кодируются одним кодоном. Свойство, которое связано с записью одной и той же информации разными символами носит название вырожденность.
Число кодонов, предназначенных для одной аминокислоты, хорошо коррелируется с частотой встречаемости аминокислоты в белках. И это, скорее всего, не случайно. Чем больше частота встречаемости аминокислоты в белке, тем чаще представлен кодон этой аминокислоты в геноме, тем выше вероятность его повреждения мутагенными факторами. Поэтому понятно, что мутированный кодон имеет больше шансов кодировать туже аминокислоту при высокой его вырожденности. С этих позиций вырожденность генетического кода является механизмом защищающим геном человека от повреждений.
Необходимо отметить, что термин вырожденность используется в молекулярной генетики и в другом смысле. Так основная часть информации в кодоне приходится на первые два нуклеотида, основание в третьем положении кодона оказывается малосущественным. Этот феномен называют “вырожденностью третьего основания”. Последняя особенность сводит до минимума эффект мутаций. Например, известно, что основной функцией эритроцитов крови является перенос кислорода от легких к тканям и углекислого газа от тканей к легким. Осуществляет эту функцию дыхательный пигмент — гемоглобин, который заполняет всю цитоплазму эритроцита. Состоит он из белковой части ― глобина, который кодируется соответствующим геном. Кроме белка в молекулу гемоглобина входит ген, содержащий железо. Мутации в глобиновых генах приводят к появлению различных вариантов гемоглобинов. Чаще всего мутации связаны с заменой одного нуклеотида на другой и появлением в гене нового кодона, который может кодировать новую аминокислоту в полипептидной цепи гемоглобина. В триплете, в результате мутации может быть заменён любой нуклеотид ― первый, второй или третий.
Известно несколько сотен мутаций, затрагивающих целостность генов глобина. Около 400 из них связаны с заменой единичных нуклеотидов в гене и соответствующей аминокислотной заменой в полипептиде. Из них только 100 замен приводят к нестабильности гемоглобина и различного рода заболеваниям от легких до очень тяжелых. 300 (примерно 64%) мутаций-замен не влияют на функцию гемоглобина и не приводят к патологии. Одной из причин этого является упомянутая выше “вырожденность третьего основания”, когда замена третьего нуклеотида в триплете, кодирующем серин, лейцин, пролин, аргинин и некоторые другие аминокислоты приводит к появлению кодона-синонима, кодирующего ту же аминокислоту. Фенотипически такая мутация не проявится. В отличие от этого любая замена первого или второго нуклеотида в триплете в 100 % случаях приводит к появлению нового варианта гемоглобина. Но и в этом случае тяжёлых фенотипических нарушений может и не быть. Причиной этому является замена аминокислоты в гемоглобине на другую сходную с первой по физико-химическим свойствам. Например, если аминокислота, обладающая гидрофильными свойствами, заменена на другую аминокислоту, но с такими же свойствами.
Гемоглобин состоит из железопорфириновой группы гема (к ней и присоединяются молекулы кислорода и углекислоты) и белка — глобина. Гемоглобин взрослого человека (НвА) содержит две идентичные a-цепи и две b-цепи. Замена в гене, кодирующем b-цепь гемоглобина первого или второго нуклеотида практически всегда приводит к появлению в белка новых аминокислот, нарушению функций гемоглобина и тяжёлым последствия для больного. Например, замена “Ц” в одном из триплетов ЦАУ (гистидин) на “У” — приведет к появлению нового триплета УАУ, кодирующего другую аминокислоту — тирозин. Фенотипически это проявится в тяжёлом заболевании. Аналогичная замена в 63 положении b-цепи полипептида гистидина на тирозин приведет к дестабилизации гемоглобина. Развивается заболевание метгемоглобинемия. Замена, в результате мутации, глутаминовой кислоты на валин в 6-м положении b-цепи является причиной тяжелейшего заболевания — серповидно-клеточной анемии. Не будем продолжать печальный список. Отметим только, что при замене первых двух нуклеотидов может появится аминокислота по физико-химическим свойствам похожая на прежнюю. Так, замена 2-го нуклеотида в одном из триплетов, кодирующего глутаминовую кислоту (ГАА) в b-цепи на “У” приводит к появлению нового триплета (ГУА), кодирующего валин, а замена первого нуклеотида на “А” формирует триплет ААА, кодирующий аминокислоту лизин. Глутаминовая кислота и лизин сходны по физико-химическим свойствам — они обе гидрофильны. Валин — гидрофобная аминокислота. Поэтому, замена гидрофильной глютаминовой кислоты на гидрофобный валин, значительно меняет свойства гемоглобина, что, в конечном итоге, приводит к развитию серповидноклеточной анемии, замена же гидрофильной глютаминовой кислоты на гидрофильный лизин в меньшей степени меняет функцию гемоглобина — у больных возникает легкая форма малокровия. В результате замены третьего основания новый триплет может кодировать туже аминокислоты, что и прежней. Например, если в триплете ЦАУ урацил был заменён на цитозин и возник триплет ЦАЦ, то практически никаких фенотипических изменений у человека выявлено не будет. Это понятно, т.к. оба триплета кодируют одну и туже аминокислоту ― гистидин.
В заключении уместно подчеркнуть, что вырожденность генетического кода и вырожденность третьего основания с общебиологических позиция являются защитными механизмами, которые заложены в эволюции в уникальной структуре ДНК и РНК.
Каждый триплет (кроме бессмысленных) кодирует только одну аминокислоту. Таким образом, в направлении кодон ― аминокислота генетический код однозначен, в направлении аминокислота ― кодон ― неоднозначен (вырожденный).
И в этом случае необходимость однозначности в генетическом коде очевидна. При другом варианте при трансляции одного и того же кодона в белковую цепочку встраивались бы разные аминокислоты и в итоге формировались белков с различной первичной структурой и разной функцией. Метаболизм клетки перешёл бы в режим работы «один ген ― несколько поипептидов». Понятно, что в такой ситуации регулирующая функция генов была бы полностью утрачена.
Считывание информации с ДНК и с иРНК происходит только в одном направлении. Полярность имеет важное значение для определения структур высшего порядка (вторичной, третичной и т.д.). Ранее мы говорили о том, что структуры низшего порядка определяют структуры более высшего порядка. Третичная структура и структуры более высокого порядка у белков, формируются сразу же как только синтезированная цепочка РНК отходит от молекулы ДНК или цепочка полипептида отходит от рибосомы. В то время, когда свободный конец РНК или полипептида приобретает третичную структуру, другой конец цепочки ещё продолжает синтезироваться на ДНК (если транскрибируется РНК) или рибосоме (если транскрибируется полипептид).
Поэтому однонаправленный процесс считывания информации (при синтезе РНК и белка) имеет существенное значение не только для определения последовательности нуклеотидов или аминокислот в синтезируемом веществе, но для жёсткой детерминации вторичной, третичной и т.д. структур.
Код может быть перекрывающимся и не перекрывающимся. У большинства организмов код не перекрывающийся. Перекрывающийся код найден у некоторых фагов.
Сущность не перекрывающего кода заключается в том, что нуклеотид одного кодона не может быть одновременно нуклеотидом другого кодона. Если бы код был перекрывающим, то последовательность из семи нуклеотидов (ГЦУГЦУГ) могла кодировать не две аминокислоты (аланин-аланин) (рис.33, А) как в случае с не перекрывающимся кодом, а три (если общим является один нуклеотид) (рис. 33, Б) или пять (если общими являются два нуклеотида) (см. рис. 33, В). В последних двух случаях мутация любого нуклеотида привела бы к нарушению в последовательности двух, трёх и т.д. аминокислот.
Однако установлено, что мутация одного нуклеотида всегда нарушает включение в полипептид одной аминокислоты. Это существенный довод в пользу того, что код является не перекрывающимся. Неперекрываемость генетического кода связана с ещё одним свойством ― считывание информации начинается с определённой точки ― сигнала инициации. Таким сигналом инициации в иРНК является кодон, кодирующий метионин АУГ. Следует отметить, что у человека всё-таки имеется небольшое число генов, которые отступают от общего правила и перекрываются.
Между кодонами нет знаков препинания. Иными словами триплеты не отделены друг от друга, например, одним ничего не значащим нуклеотидом. Отсутствие в генетической коде «знаков препинания» было доказано в экспериментах.
Код един для всех организмов, живущих на Земле. Прямое доказательство универсальности генетического кода было получено при сравнении последовательностей ДНК с соответствующими белковыми последовательностями. Оказалось, что во всех бактериальных и эукариотических геномах используется одни и те же наборы кодовых значений. Есть и исключения, но их не много.
Первые исключения из универсальности генетического кода были обнаружены в митохондриях некоторых видов животных. Это касалось кодона терминатора УГА, который читался так же как кодон УГГ, кодирующий аминокислоту триптофан. Были найдены и другие более редкие отклонения от универсальности.
Для повторения:
Генетический код ― это система записи наследственной информации в молекулах нуклеиновых кислот, основанная на определённом чередовании последовательностей нуклеотидов в ДНК или РНК, образующих кодоны, соответствующие аминокислотам в белке. Генетический код имеет несколько свойств.
1. Триплетность. Триплет состоит из трёх нуклеотидов. 61 кодон ― смысловые, т.е. кодируют какую-либо аминокислоту, три ― бессмысленные, т.е. не кодируют аминокислоты.
2. Вырожденность или избыточность. Одна аминокислота может кодироваться несколькими кодонами.
3. Однозначность. Один кодон кодирует только одну аминокислоту.
4. Полярность. Считывание информации с ДНК и с иРНК происходит только в одном направлении.
5. Неперекрываемость. Генетический код является не перекрывающимся.
6. Компактность. Между кодонами нет знаков препинания.
7. Универсальность. Код един для всех живущих на земле организмов.
 Читать 0 мин.
Читать 0 мин.