нарушение пуринового обмена код по мкб 10 у взрослых
Нарушения обмена пуринов и пиримидинов (E79)
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Гиперурикемия
Гиперурикемия – это лабораторный симптом, характеризующийся повышением уровня мочевой кислоты в сыворотке крови более 400 мкмоль/л. Данное состояние свидетельствует о нарушении пуринового обмена. Причинами гиперурикемии могут выступать чрезмерное употребление мясной пищи, прием медикаментов, метаболические расстройства и пр. В некоторых случаях наблюдаются такие симптомы как боль, покраснение и припухлость суставов, образование тофусов. Концентрация мочевой кислоты измеряется при биохимическом анализе крови. Для коррекции гиперурикемии назначается диета, уратснижающая терапия.
Классификация
По этиологии выделяют 2 основных вида гиперурикемии:
По патогенезу различают 3 типа гиперурикемии:
По клиническим проявлениям выделяют:
Причины
Физиологические причины
У здоровых людей может встречаться кратковременное или незначительное повышение концентрации мочевой кислоты (МК) без каких-либо клинических симптомов. Наиболее часто гиперурикемия наблюдается при употреблении мясной пищи, так как мясные продукты богаты пуриновыми основаниями (аденин, гуанин), которые являются субстратом для синтеза МК. Также гиперурикемия встречается при обезвоживании, интенсивной физической нагрузке, приеме алкоголя.
Подагра
Данное ревматологическое заболевание можно считать клинической манифестацией гиперурикемии. Подагра развивается вследствие генетически обусловленного дефекта ферментов, регулирующих обмен МК. К таким дефектам относятся дефицит гипоксантин-гуанинфосфорибозилтрансферазы, повышение активности 5-фосфорибозил-1-синтетазы. Нарушение функциональной активности этих ферментов приводит к усилению синтеза МК.
В периферических тканях, особенно в суставных сумках, хрящах, происходит кристаллизация солей мочевой кислоты и их отложение. В результате появляются следующие симптомы: острая, интенсивная боль в суставах (чаще в I плюснефаланговом суставе), припухлость сустава с покраснением кожных покровов. Достаточно специфичным симптомом подагры считается образование узелков – тофусов, локализующихся в основном на ушных раковинах, задней поверхности локтевых суставов. Также подагра может развиться на фоне заболеваний, влияющих на пуриновый метаболизм.
Гиперпродукция мочевой кислоты
При интенсивном разрушении клеток и их ядер происходит высвобождение нуклеотидов, из которых в последующем образуется большое количество МК, что приводит к возрастанию уровня МК. Наличие клинических симптомов возникшей гиперурикемии определяется степенью разрушения тканей. Усиленный катаболизм наблюдается при следующих заболеваниях и патологических состояниях:
Медленное выведение мочевой кислоты
Примерно 2/3 от общего количества МК выводится с мочой. Поэтому любое нарушение выделительной функции почек вследствие их органического поражения может привести к гиперурикемии. То же нередко происходит при снижении эффективного объема крови, из-за чего нарушается кровоснабжение почек. Ниже приведены основные причины подавления клиренса МК:
Другие причины
Диагностика
При обнаружении гиперурикемии необходимо обратиться к врачу-терапевту для выяснения причины ее возникновения. На приеме уточняется наличие симптомов, характерных для данного состояния. Внимательно осматриваются беспокоящие больного суставы на предмет отека или покраснения. Выясняется, имеются ли у пациента какие-либо хронические заболевания, состоит ли он на диспансерном учете, какие лекарственные средства принимает. Назначается дополнительное обследование, включающее:
Коррекция
Медикаментозное лечение
Чтобы скорректировать гиперурикемию, необходимо устранение этиологического фактора. Если в процессе сбора анамнеза выясняется, что больной принимает ЛС, вызывающее гиперурикемию, нужно рассмотреть вопрос либо о снижении дозировки, либо о замене препарата на альтернативный, но не имеющий такого побочного действия. Тактика лечения во многом определяется наличием клинических симптомов, а также их выраженностью.
Экспериментальная терапия
Продолжаются разработки и клинические исследования новых лекарственных средств для борьбы с гиперурикемией. Расбуриказа – препарат, содержащий рекомбинантную уриказу (фермент, разрушающий мочевую кислоту), показал высокую эффективность в лечении синдрома лизиса опухоли. Также данное ЛС отличается возможностью резорбции отложенных кристаллов моноурата натрия.
Перспективным является использование генно-инженерных биологических препаратов – антагониста рецепторов интерлейкина-1 (анакинра), полностью гуманизированных моноклональных антител к ИЛ-1-бета (канакинумаб), растворимого белка ИЛ-1 (рилонацепт). Их применение продемонстрировало достаточную эффективность в профилактике обострений симптомов хронического подагрического артрита.
Прогноз
Длительная гиперурикемия ассоциирована с большей частотой кардиоваскулярных осложнений – инфарктов, инсультов. Данное состояние также негативно влияет на углеводный и липидный обмен – повышает уровень липопротеидов низкой плотности, увеличивает инсулинорезистентность и усугубляет течение уже имеющегося сахарного диабета 2 типа. Поэтому обнаружение гиперурикемии требует тщательного обследования пациента и своевременного назначения терапии.
Диагностика нарушения обмена пуринов и пиримидинов в моче
Пурины и пиримидины – органические вещества, входящие в структуру нуклеиновых кислот, коферментов и макроэргических соединений. Нарушение метаболизма азотистых оснований возникает вследствие генетически обусловленных дефектов ферментов, участвующих в обмене пуринов и пиримидинов.
Наследственные дефекты метаболизма азотистых оснований.
Purine and Pyrimidine Panel, Urine.
Высокоэффективная жидкостная хроматография-масс-спектрометрия (ВЭЖХ-МС).
мкмоль / ммоль креатинина (микромоль на миллимоль креатинина).
Какой биоматериал можно использовать для исследования?
Разовую порцию мочи.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Пурины и пиримидины – гетероциклические органические азотистые вещества, входящие в состав нуклеотидов и нуклеозидов. Они являются важными структурными элементами нуклеиновых кислот (ДНК, РНК), источников энергии (например, АТФ), ферментов (НАДФ, НАД, ФАД).
К пуринам относится аденин, гуанин, ксантин, гипоксантин, к пиримидинам – урацил, тимин, цитозин, оротовая кислота. Данные вещества необходимы для хранения, транскрипции и трансляции генетической информации, роста и деления клеток, накопления энергии, передачи сигналов. В организме человека происходит эндогенный синтез пуринов и пиримидинов, взаимное превращение нуклеозидов и нуклеотидов и их катаболизм. Конечным продуктом метаболизма пуринов является мочевая кислота (2,6,8-триоксипурин). Пиримидины деградируют до бета-аланина и бета-аминоизобутирата.
Дефекты ферментов, принимающих участие в разных этапах метаболизма пуринов и пиримидинов, могут приводить к развитию заболевания. Патогенез данных состояний связан с накоплением в клетках и биологических жидкостях избыточного количества азотистых оснований и их метаболитов, которые могут быть токсичными и способными повреждать генетический материал и функцию клеток. Описано около 30 нарушений различных этапов метаболизма пуринов и пиримидинов, но клинически проявляются только 17. Основные лабораторные признаки данных заболеваний – это изменение содержания пуринов и пиримидинов в биологических жидкостях. Первые симптомы могут возникать как в раннем детстве, так и в старшем возрасте, а клинические проявления могут значительно варьироваться по степени тяжести. Наиболее часто при патологии пуринового и пиримидинового обмена повреждаются нервная система (задержка развития, аутизм, эпилептические приступы), кроветворная ткань (анемия) и почки (нефропатия, мочекаменная болезнь).
Классическим примером приобретенного нарушения пуринового обмена является подагра – заболевание, сопровождающиеся повышением уровня мочевой кислоты в крови и отложением уратов в тканях. Однако необходимо учитывать, что гиперурикемия (повышение уровня мочевой кислоты в крови) у людей старше 40 лет связана не только с генетической предрасположенностью, но и с особенностями питания, употреблением алкоголя, нарушением экскреторной функции почек. Гиперурикемия и подагра в более молодом или детском возрасте в большинстве случаев ассоциированы с наследственными дефектами ферментов пуринового обмена.
Тяжелое нарушение метаболизма пуринов – синдром Леша – Нихана (абсолютный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы), который наследуется совместно с Х-хромосомой и проявляется тяжелыми неврологическими нарушениями, задержкой психомоторного развития, церебральным параличом, аутоагрессивным поведением и уратной нефропатией. Симптомы заболевания чаще становятся заметными в возрасте 3-12 месяцев. При данной патологии в биологических жидкостях возрастает концентрация мочевой кислоты и гипоксантина.
К врождённым нарушениям пуринового обмена относятся дегидроксиаденинурия, наследственная ксантинурия, синдром Келли – Зигмиллера и др. Дефицит аденозин-дезаминазы и пурин-нуклеозид-фосфорилазы приводит не только к неврологическим нарушениям, но и к снижению количества лимфоцитов и иммунодефициту, который проявляется рецидивирующими тяжелыми инфекциями.
Патология пиримидинового обмена наблюдается и диагностируется значительно реже. К нарушениям метаболизма пиримидинов относятся оротовая ацидурия, дефицит пиримидин-5-нуклеотидазы, дефицит дигидропиримидин-дегидрогеназы.
Некоторые из наследственных нарушений обмена азотистых оснований при своевременном выявлении поддаются коррекции, для других применяется симптоматическая терапия и разрабатываются новые методы лечения. Диагноз верифицируется на основании комплексных клинико-генеалогических данных и результатов лабораторного исследования.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения, мкмоль / ммоль креатинина
Подагрический артрит
В последние годы специалисты отмечают рост заболеваемости подагрой. Лечение далеко не всегда способно предупредить очередной подагрический приступ. Часто это связано с непониманием пациентами необходимости лечения подагрического артрита в состоянии ремиссии, что приводит к хронизации патологического процесса и постепенной утрете функции суставов.
Общие сведения о заболевании
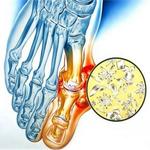
Подагрический артрит – это системное заболевание обмена веществ, связанное с отложением солей мочевой кислоты в суставных и околосуставных тканях. Болеют чаще мужчины после 40 лет. У женщин подагра встречается реже и начинается позже – в постменопаузальном периоде после 50-60 лет. Всего подагрой страдают около 2,5% данных контингентов населения. С возрастом этот процент значительно увеличивается и к 80 годам составляет 9% у мужчин м 6% у женщин. Код по МКБ-10 — М10.
Подагрический артрит коморбиден (часто сочетается) с заболеваниями почек и хронической почечной недостаточностью, сердечно-сосудистыми заболеваниями (стенокардией, высоким АД), сахарным диабетом 2-го типа, ожирением.
Несмотря на то, что лечение этого заболевания разработано, держать под контролем атаки подагры удается далеко не всегда. В основном это происходит из-за непонимания пациентами механизма развития (патогенеза) подагры и отказа или нерегулярного проведения поддерживающей терапии.
Подробнее об артрите, его симптомах и лечении в этой статье.
Причина и механизм развития (этиология и патогенез) заболевания
Причиной подагрического артрита является нарушение пуринового обмена. Пурины – это химические соединения, составляющие основу нуклеиновых кислот, необходимых для образования молекул ДНК и РНК. При распаде клеток пурины разлагаются до мочевой кислоты (МК). Последняя попадает в межклеточное пространство и в плазму крови, соединяется там с натрием, образуя соль – моноурат натрия (МУН).
При избытке уратов, когда они уже не могут растворяться в окружающей жидкости (концентрация МУН более 0,4 ммоль/л), соли кристаллизуются, откладываются в суставных и околосуставных тканях и окружаются белковыми кольцами. Такое образование называется тофусом. Высвобождение МУН из тофуса вызывает иммунологическую реакцию: в синовиальной оболочке и суставной жидкости появляется большое количество нейтрофилов (один из видов лейкоцитов, отвечающих за клеточный иммунитет).
Нейтрофилы заглатывают кристаллы МУН, что вызывает выброс провоспалительных (вызывающих и поддерживающих воспаление) цитокинов и развитие острой воспалительной реакции в синовиальной оболочке. Острые атаки в виде синовитов протекают очень болезненно, но не оставляют после себя каких-либо последствий. Длительное хроническое течение заболевания с частыми повторными атаками приводит к разрушению суставного хряща, разрастанию костной ткани, деформации и нарушению функции сустава. Отложение МУН в почках вызывает снижение их функции.
Факторы, способствующие повышению уратов в крови:
Классификация
По причинам возникновения подагрический артрит делится на формы:
По механизму накопления МУН подагра делится на типы:
По степени тяжести:
Симптомы подагрического артрита
Появлению первых симптомов подагрического артрита предшествует порой длительное увеличение концентрации уратов в крови. Поэтому мужчинам после 40 лет, а женщинам после наступления менопаузы нужно периодически проверять содержание солей мочевой кислоты (МК) в крови. Особенно важно это для тех, у кого близкие родственники страдают подагрой. Подагрический артрит развивается при концентрации в крови уратов свыше 0, 4 ммоль/л. Но при наличии такого показателя артрит проявляется только у пятой части больных, остальные могут не подозревать о наличии у себя риска развития подагры.
Первичные признаки
Первый приступ острого подагрического артрита начинается внезапно. Появляются резкие боли в пораженном суставе, ткани над ним отекают, кожа краснеет. Боли очень сильные. Может повышаться температура тела, нарушаться общее состояние больного.
В половине случаев подагрический артрит начинается с поражения одного сустава. Обычно это первый плюснефаланговый сустав стопы. Могут также поражаться коленный, локтевой, мелкие суставы кисти и др.
Явные симптомы
Атака подагрического артрита продолжается от 2 дней до 2 – 3 недель. Затем наступает полная ремиссия без каких-либо последствий. Следующий приступ обычно развивается в течение года, но иногда ремиссия продолжается несколько лет.
Острый подагрический артрит может рецидивировать в течение ряда лет, но постепенно его течение становится хроническим. Асимметрично поражается несколько суставов, в том числе, обязательно I плюснефаланговый на нижних конечностях.
Под кожей на разгибательной поверхности суставов, а также в области ушных раковин появляются тофусы – мелкие поверхностные узелки или более крупные подкожные узлы, имеющие хрящевую консистенцию. Они безболезненные, но могут воспаляться во время обострения подагрического артрита. В таком случае они становятся болезненными и иногда прорываются на поверхность кожи в виде беловатой массы.
Могут появиться приступы мочекаменной болезни – ураты отлагаются на стенках мочевыводящих путей, а также в почках, что приводит к нарушению их функции.
Когда нужно срочно обращаться к врачу
За медицинской помощью нужно обращаться, если:
Чем опасно заболевание
Подагрический артрит опасен тем, что может осложниться:
Стадии подагрического артрита
Подагрический артрит протекает в 4 стадии:
Если подагрический артрит не лечить
Что делать при обострениях
При появлении сильных суставных болей в сочетании с резким отеком и покраснением тканей, повышением температуры тела, недомоганием, следует:
Локализации
При подагре чаще всего развивается подагрический артрит суставов нижних конечностей. Могут быть и другие локализации, в том числе, поражение суставов верхних конечностей. Для подагры также характерно асимметричные суставные поражения.
Подагрический артрит нижних конечностей
При первичной подагрической атаке в патологический процесс в половине случаев вовлекается 1-ый плюснефаланговый сустав стопы. И даже если этот сустав не поражается самым первым, в дальнейшем в нем все равно развивается подагрический артрит. Околосуставные ткани отекают, кожа краснеет. В дальнейшем на тыльной поверхности стопы появляются мелкие и крупные тофусы.
Подагрический артрит голеностопного сустава встречается реже, в большинстве случаев это происходит при повторных атаках. Голеностоп воспаляется, отекает и краснеет, воспаление переходит на пятку. Возникает сильная боль и невозможность наступить на стопу.
Колено поражается часто, поражения асимметричные, часто сочетаются с поражение м 1-го плюснефалангового и локтевого суставов. Сильные боли, отек и покраснение сочетаются вначале с нарушением функции конечности из-за болей, но при длительном течении подагры происходит суставная деформация и анкилоз (неподвижность).
Тазобедренный подагрический артрит встречается редко, покраснение и отек не так заметны под мощным слоем мышц и связок. Но боли могут быть сильные.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Подагрический артрит верхних конечностей
Мелкие суставные сочленения кисти и пальцев воспаляются часто, при этом пальцы делаются похожими на сосиски. Боли, воспаление и отек очень сильные. На тыле кисти появляются крупные тофузы.
Не менее часто поражается локоть. Поражения асимметричные и часто сочетаются с вовлечением мелких суставчиков кисти и стопы. На разгибательной поверхности плеча и предплечья появляются мелкие и крупные тофусы.
Плечевой подагрический артрит развивается гораздо реже, но протекает болезненно. Отек и покраснение не выражены, на сгибательной поверхности плеча появляются тофусы.
Тофусное поражение позвоночника
В середине 50-х годов прошлого века было впервые выявлено поражение позвоночника при подагре. При этом происходит разрастание тофусов в мягких тканях и суставах позвоночника с разрушением их структур.
Чаще всего поражается поясничный отдел, затем – шейный. В спине появляются боли, которые часто принимаются за симптомы остеохондроза. При разрушении позвонков и сдавливании спинномозговых нервов и спинного мозга появляются неврологические симптомы. При поражении шейного отдела – это парезы и параличи верхних конечностей, корешковые боли.
При поражении пояснично-крестцового отдела может осложняться сдавливанием конечного отдела спинного мозга – конского хвоста. При этом нарушается функция органов малого таза – происходит непроизвольное мочеиспускание, дефекация, нарушения потенции.
Диагностика
Несмотря на то, что подагрический артрит имеет ярко выраженную симптоматику, правильный диагноз при первой атаке удается поставить только 10% больных. В остальных случаях выставляется диагноз других видов артритов. Диагностическими критериями подагры являются:
Лечение подагрического артрита
Целью лечения подагрического артрита является улучшение исходов заболевания. Для этого применяются в основном медикаментозные методы лечения. Немедикаментозные методы имеют вспомогательное значение.
Медикаментозное лечение
Основными задачами медикаментозного лечения подагрического артрита являются:
Лечение острого приступа артрита
В купировании приступа подагрического артрита используют препараты:
Снижение содержания мочевой кислоты в крови в межприступный период
Вне приступов пациентам, страдающим подагрическим артритом, назначают длительные курсы уратснижающей терапии (УСТ), понижающие содержание мочевой кислоты (МК) в сыворотке крови, предупреждающие образование кристаллов МК в тканях. При низком содержании МК в крови уже имеющиеся в тканях кристаллы постепенно рассасываются. При наличии хронического подагрического артрита, тофусов содержание МК снижают до минимального (ниже 0,3 ммоль/л), что способствует ускоренному устранению тофусов. При отсутствии тофусов допустимо содержание МК равное 0,36 ммоль/л.
Для уратснижающей терапии при подагрическом артрите применяют следующие группы лекарственных препаратов:
Пегуриказа – это уриказа с полиэтиленгликолем, который подавляет повышенную аллергенность. Более современный препарат, но он также применяется строго по показаниям.
Медикаментозная терапия поражений почек, обусловленных нарушениями обмена пуринов
Рассмотрены подходы к медикаментозному лечению пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов. Описаны лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии.
Approaches to drug treatment of patients with renal diseases caused by purines metabolism disorders, are examined. Medications used for pathogenic treatment of gouty nephropathy are described.
Пуриновый обмен представляет собой сложный каскад биохимических реакций, в котором принимают участие многие ферментные системы. Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Большая часть солей мочевой кислоты — уратов — образуется эндогенно в процессе метаболизма нуклеиновых кислот, однако существуют и другие пути биосинтеза этих веществ. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников. Существенное значение также имеет поступление значительного количества пуринов с продуктами питания.
Считается, что в организме взрослого здорового человека содержится около 1000 мг мочевой кислоты. При нарушениях обмена пуринов этот показатель может возрастать в несколько раз. Содержание мочевой кислоты в организме не является жестким параметром и не имеет какой-либо диагностической ценности. Даже основной показатель состояния пуринового обмена — концентрация мочевой кислоты в сыворотке крови особой жесткостью не отличается. Минимальное и максимальное значения нормы отличаются примерно в 2,5 раза — 200–450 мкмоль/л у мужчин и 160–400 мкмоль/сут у женщин. У здоровых людей за сутки выводится и вновь синтезируется примерно 750 мг или 2/3 от общего объема мочевой кислоты. Из этого количества около 80% или 600 мг экскретируется почками. Оставшиеся 20% выводятся через желудочно-кишечный тракт. По оценке П. М. Клименко и соавт. (2010) клиренс мочевой кислоты в норме составляет 5,4–9,0 мл/мин [1].
Почечная экскреция уратов представляет собой сложный и многоступенчатый процесс. В клубочках происходит фильтрация уратов плазмы. Попавшие в ультрафильтрат ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются в просвет нефрона. Некоторая часть секретированных уратов повторно реабсорбируется. Процесс активной секреции уратов очень чувствителен к различным химическим агентам. Считается, что почечную секрецию уратов повышают оротовая кислота, лозартан, эстрогены, продукты распада тетрациклина (просроченные тетрациклины обладают высокой токсичностью!); почечную экскрецию уратов понижают этамбутол, тиазиды и тиазидоподобные диуретики, в меньшей степени фуросемид и ацетазоламид [2]. Вполне очевидно, что выраженность отмеченных эффектов сильно изменяется от препарата к препарату и далеко не всегда имеет клиническое применение. В частности, урикозурические свойства эстрогенов существенного значения не имеют. Лозартан в последнее время стал фигурировать в схемах лечения подагрического тубулоинтерстициального нефрита у пациентов, не имеющих нефролитиаза [3]. Склонность тиазидов и индапамида уменьшать почечную экскрецию уратов и повышать их сывороточную концентрацию выражена достаточно ярко, что делает эти препараты как минимум нежелательными при суставной подагре и, особенно, при подагрической нефропатии.
Клинические варианты поражения почек вследствие нарушения пуринового обмена
Заболевания, связанные с нарушениями пуринового обмена, встречаются сравнительно часто, что делает актуальными вопросы, связанные с их лечением. Специалисты-урологи, а также большинство врачей общей практики хорошо знакомы с особенностями уратного нефролитиаза. В то же время эти специалисты нередко вовсе не имеют представления о существовании других, подчас более тяжелых заболеваний, обусловленных нарушениями пуринового обмена. Между тем все они встречаются с разной частотой в стационарах, а также при оказании амбулаторной медицинской помощи.
Наиболее значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови — гиперурикемия, которая и является основным этиологическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную (не имеющую явной причины) и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого термина. Сюда входит и классический острый микрокристаллический артрит, и различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и осложнения всех этих состояний.
В группе заболеваний, связанных с первичной гиперурикемией, несколько особняком стоят генетически обусловленные нарушения пуринового обмена. Среди них синдром Леша–Нихена, болезнь Гирке, различные варианты наследственных дефектов транспортных систем почечных канальцев и другие. Отличительными признаками гиперурикемий, наследуемых по моногенному типу (то есть связанных с дефектом конкретного гена, определяющего развитие всего симптомокомплекса), являются манифестация в раннем детском возрасте, высокая гиперпродукция мочевой кислоты, быстрое, иногда даже «злокачественное» прогрессирование заболевания вплоть до формирования терминальной почечной недостаточности, часто весьма умеренная эффективность лечебных мероприятий, несмотря на максимально активную терапию [4].
Клиническая диагностика нарушений пуринового обмена, наследуемых по полигенному типу, в настоящее время затруднена. Проявления и характер течения заболевания в этом случае сильно варьируют в зависимости от внешних факторов, а биологический эффект значительной части генов все еще не до конца ясен [3, 4].
В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие солей мочевой кислоты на почечные структуры, также предлагался термин «уратная нефропатия». Все эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Отдельные авторы также отмечают возможность иммунокомплексного гломерулонефрита, пусковым фактором которого служит гиперпродукция мочевой кислоты [5].
В урологической практике наиболее часто встречаются пациенты с уратным нефролитиазом. До 80% таких пациентов хотя бы один раз в жизни имели эпизод острого артрита, причем совершенно необязательно классической локализации — I плюснефалангового сустава. В последнее время все чаше встречаются атипичные варианты подагрического артрита, например, гонит. Кроме того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с меньшей активностью воспалительного процесса. Можно отметить, что сочетание артрита и уратного нефролитиаза является не обязательным, а, скорее, характерным [5, 6].
Клиническая картина конкремента почки, мочеточника общеизвестна, поэтому еще раз ее подробно описывать смысла нет. Единственно, стоит отметить, что при наиболее тяжелом, «злокачественном» течении, наряду с образованием уратных камней в просвете мочевых путей, возможно и отложение кристаллов урата в почечном интерстиции, что носит название «нефрокальциноз». В отличие от нефролитиаза, нефрокальциноз при подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет нефросклероза. Нефрокальциноз в большинстве случаев выявляется при ультразвуковом сканировании и требует специфической терапии.
Хронический тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако, ввиду меньшей яркости клинической картины, он известен главным образом специалистам-нефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает в основном канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек — полиурия с низкой плотностью мочи (гипостенурией). Протеинурия не превышает 1 г/сут или вовсе отсутствует — она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита характерна стойкая уратурия, а также стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции.
Уровень урата крови также закономерно повышен, однако необходимо помнить, что сам по себе факт наличия хронической почечной недостаточности также является причиной гиперурикемии. При явной клинической картине хронического тубулоинтерстициального нефрита его связь с нарушениями пуринового обмена не вызывает сомнений при следующих соотношениях уровней урата и креатинина крови: соответственно > 536 мкмоль/л и 595 мкмоль/л и 132–176 мкмоль/л; > 714 мкмоль/л и > 176 мкмоль/л [7].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было отмечено свечение С3-фракции комплемента и IgG, что характерно для иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как отдельный вариант подагрической нефропатии [6].
При прогрессировании подагрического тубулоинтерстициального нефрита закономерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия (острая подагрическая почка) в своей основе имеет обструкцию почечных канальцев кристаллами уратов, что приводит к острой почечной недостаточности. Заболевание начинается с олигурии. Часть пациентов одновременно предъявляет жалобы на болевой синдром по типу почечной колики, макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику. Патогномоничной является высокая уратурия, не характерная для острой почечной недостаточности другой этиологии, а также значительное повышение уровня мочевой кислоты в крови (выше 850–900 мкмоль/л). В современной нефрологической практике считается, что диагноз острой мочекислой нефропатии не вызывает сомнений при соотношении уровней урата и креатинина крови (в мг) > 1 [8].
Предположение об острой мочекислой нефропатии основывается на сочетании трех клинических признаков — высокоактивного артрита с характерной локализацией, резкого уменьшения диуреза и кирпично-бурого цвета мочи. Диагноз тем более вероятен, если пациент указывает на имевшую место гипогидратацию любого генеза — от посещения бани и физической работы при высокой температуре воздуха до неадекватной инфузионной терапии и передозировки мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При естественном течении заболевания олигурия практически всегда прогрессирует до анурии с развернутой клинической картиной острой почечной недостаточности.
Проблема острой мочекислой нефропатии тесно прилежит к вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в сыворотке крови довольно многочисленны и разнообразны. Среди них: хроническая почечная недостаточность, независимо от этиологии, ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, саркоидоз, хроническая интоксикация свинцом, хронический алкоголизм. Прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного. В большинстве случаев выраженность гиперурикемии при этих заболевания небольшая, реже умеренная. Таким образом, нарушения пуринового обмена довольно редко значимо отражаются на клинической картине заболевания.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [11]. Однако тяжелая гиперурикемия, обусловленная генетическими нарушениями, крайне редко приводит к острой мочекислой нефропатии [3, 4].
Медикаментозная терапия заболеваний почек, обусловленных нарушениями пуринового обмена
Консервативная терапия любого варианта подагрической нефропатии в основе своей имеет снижение уровня гиперурикемии, а следовательно, и гиперурикурии, а также повышение растворимости урата в моче.
Всем пациентам в обязательном порядке назначается диета, цель которой уменьшить поступление пуринов в организм с пищей. Это достигается полным исключением из рациона мяса молодых животных, субпродуктов, мясные бульоны, колбас и т. д., ограниченно разрешается мясо полновозрастных животных, рыба. Пациентам рекомендуется преимущественно растительный стол, обильное щелочное питье, цитрусовые и напитки на их основе, а также полное воздержание от алкоголя.
При наличии почечной недостаточности, артериальной гипертензии, недостаточности кровообращения, ожирения вводятся дополнительные ограничения. Прежде всего, рекомендуют снизить потребление поваренной соли, так как эффективность ингибиторов АПФ, особо показанных при нефропатиях, осложненных артериальной гипертензией, да и вообще всей гипотензивной терапии напрямую зависит от объема поступающего в организм натрия. При выраженном дефиците фильтрации появляется необходимость в ограничении потреблении белка. При ожирении уменьшают общую калорийность рациона.
У ряда пациентов, например, при редко рецидивирующем уратном нефролитиазе без почечной недостаточности, при достаточной мотивации со стороны больного, вообще удается ограничиться коррекцией диеты и питьевого режима, не прибегая к назначению лекарственных препаратов.
Лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии, подразделяются на:
Базовым препаратом, влияющим на метаболизм пуринов, является аллопуринол, являющийся ингибитором фермента ксантиноксидазы. Под действием этого фермента происходит последний этап синтеза мочевой кислоты. Предшественники урата ксантин и гипоксантин имеют практически в 10 раз более высокую растворимость в воде по сравнению с мочевой кислотой. Остановка метаболизма пуринов на этом этапе сводит практически до нуля риск кристаллообразования, а значит, и микрокристаллического артрита, и нефропатии.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка — 200 мг/сут, среднетерапевтическая — 300–400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным, дозировки аллопуринола — 600–900 мг/сут [2].
Аллопуринол склонен вызывать диспептические расстройства и кожную сыпь, которые отмечаются практически у каждого пятого больного. Побочные действия этого препарата чаще носят характер неприятных, но не опасных, и ввиду практически полной (вплоть по последнего времени) безальтернативности этого препарата большая часть пациентов все-таки продолжает лечение.
В последнее время на отечественном рынке появился новый ингибитор ксантиноксидазы фебуксостат, который отличается от аллопуринола более высокой селективностью [3]. Отечественный опыт применения фебуксостата пока крайне ограничен, однако зарубежные исследователи отмечают его более высокую эффективность в отношении гиперурикемии [9]. Однако уже сейчас можно отметить, что этот препарат является полноценной заменой аллопуринола в условиях его непереносимости, аллергии и т. д.
В заключение необходимо отметить, что ингибиторы ксантиноксидазы противопоказаны пациентам, получающим азатиоприн и 6-меркаптопурин, так как этот фермент принимает участие в их метаболизме. При совместном назначении резко возрастает риск токсичности, прежде всего костномозговой.
За рубежом также применяется рекомбинантная уратоксидаза — расбуриказа. Препарат существенно эффективнее аллопуринола снижает гиперурикемию и применяется, главным образом, в гематологической практике для профилактики острой уратной нефропатии [3].
Лекарственные средства, увеличивающие почечное выведение пуринов, — урикозурические препараты — угнетают процесс реабсорбции урата из просвета почечных канальцев. В современной клинической практике эта группа лекарственных средств применяется очень ограниченно. Далеко не у всех пациентов они демонстрируют достаточную эффективность. Кроме того, результатом прямого фармакологического эффекта — увеличения почечной экскреции урата — является рост риска нефролитиаза. Самый известный урикозурический препарат — пробенецид в настоящее время практически отсутствует на отечественном рынке. Бензбромарон зарегистрирован в России, но имеется лишь в очень небольшом количестве. Все урикозурические средства в организме подвергаются печеночному метаболизму и обладают некоторой гепатотоксичностью. Еще одной особенностью этих препаратов является огромное число лекарственных взаимодействий, что затрудняет их применение в составе многокомпонентных схем.
Цитратная терапия является неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую растворимость и легко переходят в твердую фазу — кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей увеличивается. Основным эффектом цитратов является способность защелачивать мочу, что предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается растворимость фосфатов. Наслоение пленки фосфата на уратный камень делает практически бесперспективным процесс дальнейшего литолиза. Это диктует необходимость тщательного контроля за реакцией мочи на протяжении всего курса лечения. В современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной кислотой и ее солями, пришли лекарственные средства, включающие в себя химически чистый цитрат и набор тест-полосок для мониторирования реакции мочи.
Исследования 1980–90-х гг. продемонстрировали эффективность литолиза уратных камней с применением цитратных смесей в режиме монотерапии порядка 75–80% [10, 11]. В настоящее время в результате совершенствования методики эффективность литолиза удалось повысить до 85–90% в зависимости от особенностей химического состава конкрементов [1, 12, 13].
В последние годы появились работы, свидетельствующие о целесообразности включения препаратов цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно его дистальной трети, комбинированная терапия, включающая цитрат и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается от групп пациентов, получавших монотерапию этими препаратами (68,8% и 58,8% соответственно), а также от пациентов, получавших плацебо (26,1%) [14].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей цитрат 3 г/сут и аллопуринол 100–200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой. Также существенно повысился и клиренс мочевой кислоты. Отметим низкую дозировку аллопуринола. Минимально эффективной считается 200 мг/сут, а 100 мг/сут — вообще субклиническая дозировка, тем не менее, она оказалась эффективной. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и цитрата. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. К сожалению, авторы не акцентировали на этом внимание [15].
Более яркий эффект цитрата в отношении функции почек отмечен при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов, страдающих ожирением [16].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является одним из факторов, способствующих камнеобразованию. Этим может объясняться эффективность цитратных смесей не только при уратном, но и при кальций-оксалатном нефролитиазе [17–19].
Наряду с вышеописанными механизмами действия, соли лимонной кислоты дополнительно обладают антисептическим, цитопротективным и метаболическим эффектами, которые также могут находить применение в клинической практике. В частности, C. Strassner и A. Friesen сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратными смесями, что, вероятно, связано с изменением реакции мочи [20]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток P. Bruhl и соавт. предотвращать с его помощью химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов — циклофосфамидом и ифосфамидом [21] (в современной онкологической и нефрологической практике с этой целью применяется препарат из группы муколитиков — месна, практически не влияющий на кислотно-щелочное состояние). Кроме того, сообщается об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [22].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н. К. Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений уровня рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [23]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам уровня рН, что может вызвать кристаллизацию фосфата.
Ввиду того, что цитрат в норме присутствует в организме, лекарственные средства на его основе практически лишены токсичности. Тем не менее, существуют клинические ситуации, когда применение этих препаратов требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой нефропатии и вообще при острой почечной недостаточности любой этиологии. Лимитирующим фактором здесь выступает не цитрат-ион, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4% раствора гидрокарбоната натрия, физиологического раствора и т. д. в сочетании с петлевыми диуретиками. Необходимо поддерживать диурез на уровне не менее 100–150 мл/час, рН мочи не ниже 6,5. При возможности назначаются ингибиторы ксантиоксидазы. Цитратные смеси целесообразны при восстановлении диуреза и достижении скорости клубочковой фильтрации 25–30 мл/мин, когда риск гиперкалиемии практически отсутствует [5, 6].
При тяжелой недостаточности кровообращения лимитирующим фактором является повышенное поступление в организм натрия, также содержащегося в цитратных смесях. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид. Данный препарат из группы диуретиков — ингибиторов карбоангидразы сильно, а главное, неконтролируемо защелачивает мочу, что делает его неконкурентоспособным по сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид — практически единственная возможность повысить уровень рН мочи, не прибегая к введению солей, что в условиях тяжелой сердечной недостаточности крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов, несмотря на весьма ограниченный выбор лекарственных препаратов и кажущуюся простоту их выбора, представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Литература
ФГБУ НИИ урологии МЗ РФ, Москва