на что влияет генетический код
Переписать код жизни: 12 важных вопросов о редактировании генома
Теперь у нас есть точный способ корректировать, заменять или даже удалять дефектные ДНК. Научный редактор The Guardian Ян Сэмпл объясняет научную сторону редактирования генома и риски, которые могут возникнуть в будущем.
Так что же такое редактирование генома?
Учёные сравнивают это с программами в компьютере, которые находят и заменяют ошибки в тексте. Только вместо исправления слов, редактор генома исправляет ДНК – биологический код, который является своеобразной «инструкцией» к живым организмам. С помощью редактирования генома исследователи могут деактивировать отдельные гены, корректировать вредоносные мутации и изменять активность специфичных генов у растений и животных – в том числе и у людей.
В чем смысл?
Энтузиазм вокруг темы редактирования генома объясняется возможностью лечить или предотвращать заболевания. Существуют тысячи генетических нарушений, которые передаются от поколения к поколению; многие из них – серьёзные и разрушительные. И они не редки: один ребёнок из двадцати пяти рождается с генетическим заболеванием. Среди самых распространённых – муковисцидоз (заболевание, которое характеризуется поражением желез внешней секреции – прим.), серповидноклеточная анемия (изменение строения белка гемоглобина, ведущее к тяжёлой форме анемии – прим.) и мышечная дистрофия.
Редактирование генома вселяет надежду на то, что эти болезни могут быть побеждены путём «переписывания» повреждённых генов в клетках пациента. Однако починка дефектных генов – это ещё не все возможности; уже есть опыт модифицирования иммунных клеток человека для борьбы с раком или для повышения их устойчивости к ВИЧ-инфекции. Также возможно исправление дефектных генов у человеческого эмбриона – таким образом можно предотвратить наследование серьёзных заболеваний. Но эта технология неоднозначна, так как генетические изменения могут распространиться на сперму или яйцеклетки пациента, то есть все внесённые генетические корректировки и любые побочные эффекты могут быть переданы следующим поколениям.
В каких ещё сферах применяется редактирование генома?
Некоторые отрасли медицины также воспользовались потенциалом новой технологии. Компании, работающие над производством антибиотиков нового поколения, разработали вирусы, которые сами по себе безопасны, но умеют находить и атаковать специфичные, вызывающие опасные инфекции штаммы бактерий. Также учёные используют редактор генома, чтобы обезопасить пересадку органов свиньи человеку. Помимо этого, редактирование генома повлияло на фундаментальные исследования, позволив учёным более точно понимать, как работают те или иные гены.
Так как это работает?
Есть множество способов редактировать гены, но настоящим прорывом в последние годы стал молекулярный инструмент Crispr-Cas9. Он использует особый участок бактериальной ДНК – CRISPR (буквально: короткие палиндромные повторы, регулярно расположенные группами) – чтобы найти специфическую область в генетическом коде организма, например, мутировавший ген. Эта область в дальнейшем отсекается с помощью фермента Cas9. В попытках восстановить повреждения клетка часто «отключает» этот ген. Этот способ очень полезен для работы с «вредоносными генами», но возможны и другие способы. Например, чтобы исправить дефектный ген, учёные могут разрезать мутировавшую ДНК и заменить здоровой цепочкой, которая доставляется вместе с молекулами Crispr-Cas9. Вместо Cas9 могут быть использованы другие ферменты, которые могут помочь редактировать ДНК более эффективно — например, Cpf1.
Напомните-ка, что такое гены?
Ген – это биологический шаблон, который организм использует для создания протеинов и ферментов, необходимых для построения и поддержания тканей и органов. Он представляет собой цепочку генетического кода, обозначаемого буквами G, C, T и A. У человека есть около 20 тысяч генов, сгруппированных в 23 пары хромосом, которые, в свою очередь, содержатся в ядре почти каждой клетки тела. Только около 1.5% нашего генетического кода, или генома, состоят из генов. Ещё 10% регулируют их, удостоверяясь, например, что гены включаются и выключаются в нужных клетках в нужное время. Остальная часть ДНК, судя по всему, бесполезна. «Бóльшая часть нашего генома не делает ничего, – говорит Джертон Лантер, генетик из Оксфордского Университета. – Это просто осколок эволюции».
Что за G, C, T и A?
Буквы генетического кода соответствуют молекулам гуанина (G), цитозина (С), тимина (Т) и аденина (А). В ДНК эти молекулы идут попарно: G и С, Т и А. Эти «основные пары» являются ступенями всем знакомой двойной спирали ДНК. Чтобы составить один ген, нужно много таких ступеней. Мутировавший ген, ответственный за муковисцидоз, содержит около 300.000 базовых пар, а за мышечную дистрофию – около 2,5 миллионов пар, это самый длинный ген в человеческом теле. Каждый из нас наследует от наших родителей около 60 новых мутаций, большинство – от отцов.
Но как добраться до нужных клеток?
Это весьма трудная задача. Большинство лекарств – это маленькие молекулы, которые могут путешествовать по телу с потоком крови, именно так они доставляются к органам и тканям. По сравнению с ними, молекулы, используемые в редакторе генома, огромны и доставить их к клеткам сложно. Но возможно. Один способ – добавить молекулы редактора генома в безвредные вирусы, которые инфицируют определённые типы клеток. Миллионы таких вирусов после этого вводятся в кровь или напрямую в поражённые ткани. Оказавшись в теле, вирусы вторгаются в необходимые клетки и высвобождают молекулы редактора генома, чтобы те делали свою работу. В 2017 году учёные из Техаса таким образом вылечили мышей от мышечной дистрофии Дюшена. Следующий шаг – клинические испытания на человеке.
Однако вирусы – не единственный способ доставить молекулы к клеткам. Исследователи использовали жировые наночастицы для переноса молекул Crispr-Cas9 к печени, а также короткие импульсы электричества, чтобы «открыть» поры эмбриона и через них ввести молекулы редактора генома.
Редактирование обязательно делать в самом организме?
Нет. Во время одного из самых первых испытаний редактора генома учёные забирали клетки из крови пациента, выполняли необходимые генетические корректировки и вводили исправленные клетки обратно. Такой метод выглядит многообещающим для лечения для людей, живущих с ВИЧ. Когда вирус попадает в организм, он инфицирует и убивает иммунные клетки. Но чтобы инфицировать иммунную клетку, ВИЧ сначала должен прицепиться к определённым белкам на её поверхности. Учёные выделили иммунные клетки из крови пациента и использовали редактор генома, чтобы вырезать ту ДНК, которая нужна клеткам для образования этих поверхностных белков. Без них ВИЧ не может получить доступ к клеткам.
Подобный способ может использоваться для борьбы с некоторыми типами рака: иммунные клетки выделяются из крови пациента и редактируются так, что они больше не могут синтезировать поверхностные белки, к которым цепляются раковые клетки. Отредактировав иммунные клетки и сделав из них «убийц рака», учёные размножают их и вводят обратно в организм пациента. Прелесть модифицирования клеток вне организма в том, что всё можно перепроверить до того, как вводить обратно, чтобы убедиться, что процесс редактирования проведён верно.
А что может пойти не так?
Современное редактирование генома довольно точное, но не идеальное. Процедура похожа на прицельную стрельбу – надо попасть по нужным клеткам, а по остальным – промахнуться. Даже если Crispr попадает куда нужно, изменения могут отличаться от клетки к клетке, например, в одной нужно исправить две копии мутировавшего гена, а в другой – только одну. Для некоторых генетических заболеваний это не столь важно, но становится проблемой, если заболевание возникает из-за единственного мутировавшего гена. Другая трудность возникает, когда изменения были произведены в неправильном участке генома. Таких «выстрелов не по мишени» может быть сотни, и они могут быть опасны, если разрушают здоровые гены или критически важные регуляторы ДНК.
Приведёт ли это всё к «редактированию» будущих детей?
Огромные усилия в медицине направлены на то, чтобы исправить дефектные гены у детей и взрослых. Но некоторые исследования показали, что есть возможность редактировать гены у эмбрионов. В 2017 году учёные, созванные Национальной Академией Наук и Национальной Академией Медицины США, сдержанно поддержали редактирование генома у человеческих эмбрионов для предотвращения самых серьёзных заболеваний, но только один такой опыт оказался безопасным.
Любые изменения на эмбриональной стадии повлияют на все клетки человека и будут переданы его детям, поэтому очень важно избегать вредоносных ошибок и побочных эффектов. Проектирование человеческих эмбрионов также поднимает вопрос непростой перспективы «дизайна» детей, когда эмбрионы редактируются больше по социальным, чем по медицинским причинам; например, чтобы сделать человека выше или умнее. Однако такие черты могут контролироваться тысячами генов, большинство из которых ещё неизвестны. Поэтому на данный момент перспектива редактирования генома будущего потомства весьма отдалённая.
Когда редактирование будет доступно простым пациентам?
Открытие клиникам доступа к редактированию генома – практически на финишной прямой. Около десятка испытаний Crispr-Cas9 запланированы или проводятся прямо сейчас. Большинство из них ведётся китайскими исследователями с целью борьбы с разными формами рака. Одно из первых исследований было запущено в 2016 году, когда учёные из провинции Сычуань вводили отредактированные иммунные клетки пациентам с поздней стадией рака лёгких. Большинство американских и европейских исследований ожидают своего начала в течение следующих нескольких лет.
Что дальше?
Базовое редактирование
Более мягкая форма редактирования генома – без разрезания ДНК на кусочки – использует химические реакции, чтобы изменить буквы генетического кода. Пока что это выглядит неплохо. В 2017 году исследователи в Китае использовали базовое редактирование для исправления мутаций, которые вызывают серьёзные нарушения кровеносной системы: как, например, гемолитическая анемия у человеческих эмбрионов.
Перемещение генов
Спроектированное перемещение генов может доставить определённые гены целым популяциям организмов. Например, таким образом можно сделать москитов бесплодными и сократить количество заболеваний, которые они распространяют. Но эта технология очень противоречива, так как может иметь широкомасштабные непреднамеренные экологические последствия.
Редактирование эпигенома
Иногда нет цели полностью удалить или заменить ген – необходимо просто ослабить или усилить его активность. Сейчас учёные работают над способностью Crispr выполнять такие задачи, предоставляя его молекулам больше возможностей, чем раньше.
Перевод: Кира Луппова.
Подписывайтесь на страницу СПИД.ЦЕНТРа в фейсбуке
Что такое ДНК и хромосомы
Что такое ДНК, и из чего она состоит? Кто и когда открыл эту молекулу в клетках человека и других живых организмов? Чем уникален открытый учеными механизм наследования, и какие последствия ждал весь мир после этого открытия? Всю необходимую информацию Вы можете узнать, прочитав эту статью.
Когда впервые в истории появилось упоминание о ДНК
Иоганнес Фридрих Фишер – врач и биолог-исследователь родом из Швейцарии, стал первым в мире ученым, выделившим нуклеиновую кислоту. Открытие случилось в 1869 году, когда он занимался изучением животных клеток, а именно лейкоцитов, которых много содержалось в гное. Совершенно случайно молодой ученый заметил, что при отмывании лейкоцитов с гнойных повязок от них остается загадочное соединение. Под микроскопом Иоганн обнаружил, что оно содержится в ядрах клеток. Это соединение Мишер назвал нуклеином, а в процессе изучения его свойств переименовал в нуклеиновую кислоту, из-за наличия свойств, как у кислот.
Роль и функции только открытой нуклеиновой кислоты были неизвестны. Однако многие ученые того времени уже высказывали свои теории и предположения о существовании механизмов наследования.
Нынешние взгляды на состав молекулы ДНК ассоциируются у людей с именами английских ученых Джорджа Уотсона и Фрэнсиса Крика, которые открыли структуру данной молекулы в 1953 году. За несколько лет до этого, в тридцатые годы, ученые из советского союза А.Н. Белозерский и А.Р. Кезеля доказали наличие ДНК в клетках во всех живых организмах, тем самым они опровергли теорию о том, что молекула ДНК находится только в клетках животных, а в клетках растений присутствует только РНК. Лишь спустя несколько лет, в 1944 году, группой освальдских ученых было установлено, что молекула ДНК является механизмом сохранения наследственной информации клетки. Таким образом, благодаря совместным усилиям и трудам исследователей человечество познало тайну процесса эволюции и его основных принципов.
ДНК в медицине
Открытие состава молекулы дезоксирибонуклеиновой кислоты позволило перейти медицине на новый уровень развития. Появилось большое количество новых направлений практической медицины, стали доступны новые методы лечения, диагностики. Благодаря этому фундаментальному открытию для науки и современным технологиям, человечеству стали доступны:
И это еще не все доступные для людей услуги, которые может предложить медицина, изучающая генетику. Выше были представлены только самые популярные среди людей тесты. Перспективой для многих ученых-генетиков является создание таких лекарств, способных победить все болезни на Земле и даже смертность.
Строение молекулы ДНК
От цепочки к хромосоме
В каждом живом организме находится миллионы клеток, а внутри этих клеток находится ядро. Клетки, содержащие в себе ядро, называются эукариотами или ядерными. У древних одноклеточных нет оформленного ядра. К таким безъядерным одноклеточным, или прокариотам, относятся бактерии и археи, например, кишечная палочка или серая анаэробная бактерия. Также ядро отсутствует в клетках вирусов и вироидов, однако причисление вирусов к живым организмам – вопрос спорный, о котором по сей день дискуссируют ученые.
В ядре находятся хромосомы – структурный элемент, в котором содержится молекула ДНК в виде спирали, хранящая внутри себя всю генетическую информацию клетки.
Процесс упаковки ДНК спиралей
Количество нуклеотидов в ДНК велико, и нужны длинные цепочки, чтобы вместить все их число, поэтому нити ДНК закручиваются в две спирали, что позволяет укоротить цепочки в 5 раз, сделав их более компактными. Нити ДНК могут также закручиваться в форму суперспирали. Двойная спираль пересекает свою ось и накручивается на специальные гистоновые белки – гиразы, образуя при этом супервитки. Таким образом, двойная спираль закручивается в спираль более высокого порядка. Сокращение цепочек в этом случае произойдет в 30 раз.
Как гены связаны с ДНК
Ген – самый изученный на сегодняшний день участок ДНК. Гены являются структурной единицей наследственности всех живых организмов. Цепочки нуклеотидов в ДНК состоят из генов, которые определяют генотип особи, например, цвет и разрез глаз, тип кожи, рост, группу и резус фактор крови и другие физиологические качества и особенности внешности.
Еще много отраслей генетики до конца не изучены, и до конца не раскрыты все функции генома, но ученые до сих пор продолжают изучение генов, чтобы добиться новых открытий в области генетики.
Хромосома: определение и описание
Хромосомы – структурный элемент клетки, находящийся внутри ядра. Они содержат в себе молекулы ДНК, в которых содержится вся наследственная информация.
Строение и виды хромосом:
Отсюда возникают различные типы хромосом:
Всего в клетке человека находится 46 хромосом: 22 пары аутосом, встречающиеся у обоих полов, и одна пара половых хромосом: XY – у мужчин, XX – у женщин. Забавно, что если прибавить к количеству хромосом хотя бы одну пару, то человек мог бы быть шимпанзе или тараканом, а если отнять, то – кроликом.
Еще интересно то, что человек и ясень имеют одинаковое количество хромосом, несмотря на принадлежность к разным видам и царствам.
Наследственные болезни
Генетический код – система записи генетической информации в ДНК и РНК в виде определенной последовательности в цепочке нуклеотидов. Он должен сохранять наследственную информацию в первоначальном виде, восстанавливая повреждения цепочки в последующем поколении с помощью ДНК. Однако ген может каким-то образом быть поврежден, либо в нем может произойти мутация.
Генные мутации – изменение в последовательности нуклеотидов, например выпадение, замена, вставка другого нуклеотида в цепочку. Последствия этих мутаций могут быть полезные, вредные или нейтральные. Примером полезных мутаций является устойчивость к минусовым температурам, увеличенная плотность костей, меньшая потребность во сне, устойчивость к ВИЧ и другие. Примером вредных мутаций является аллергия на солнечный свет, глухота слепота и так далее. К нейтральным мутациям относятся те мутации, которые не влияют на жизнеспособность, например, гетерохромия.
Существуют также летальные и полулетальные мутации. Летальные мутации несовместимы с жизнью и приводят к гибели организма на ранних этапах его развития, например, при рождении у особи отсутствует головной мозг. Полулетальные мутации не приводят к смерти особи, но значительно уменьшают ее жизнеспособность. К таким мутациям относятся заболевания человека, передающиеся по наследству. Например, наличие 47-й хромосомы может вызвать у человека синдром Дауна, а, наоборот, отсутствие 46-й парной хромосомы – сидром Шерешевского-Тернера.
Расшифровка цепочки ДНК
Расшифровка цепочки ДНК в клетке – это исследование всех известных генов в клетках человека. Хоть цена за такую услугу значительно упала за последние десять лет, однако такое исследование по-прежнему остается дорогим удовольствием, и не каждый человек сможет позволить себе оплатить такую услугу. Чтобы уменьшить цену этого исследования, расшифровку ДНК стали делить по тематикам. Таким образом, появились различные тесты, которые исследуют интересующую человека группу генов и ее функции.
Как происходит расшифровка цепочки ДНК?
Таким образом, ученые получают картину гена, которую можно изучить и расшифровать. Синтез РНК Нуклеотиды делятся на четыре базовых элемента, служащими основой для формирования генов: АТГЦ, или аденин, тимин, гуанин, цитозин. В их состав входят фосфорные остатки, азотистые основания и пептоза.
Важно, что молекула дезоксирибонуклеиновой кислоты не должна выходить за пределы мембраны ядра. С помощью РНК, которая играет роль копии участка цепи с генетическим кодом, генетическая цепочка может покинуть ядро, попасть вовнутрь клетки и воздействовать на ее внутренние процессы.
Как это происходит:
Итак, группа генов, участвующих в процессе старения клеток может, как заставить процесс старения идти быстрее, так и вовсе его остановить и запустить процесс омолаживания. То есть, каждый из генов может спровоцировать синтез нескольких видов белка.
Сутягина Дарья Сергеевна
В нашей ДНК содержится очень много информации, но пока мы можем расшифровать лишь небольшой процент генов. Добавлю несколько интересных фактов о ДНК: возможность двойной ДНК у человека. Такое явление случается, когда при беременности в утробе развиваются близнецы, но в процессе развития плода они сливаются в одного человека. Длина одной молекулы ДНК человека равна 2 метрам, а общая длина цепочки ДНК всех клеток тела человека равна 16 млрд. километрам, что равно расстоянию от Земли до Плутона. ДНК человека и кенгуру всего лишь 150 млн. лет назад были одинаковыми. Все знания и информация во всем мире могла бы уместиться всего лишь в 2 граммах дезоксирибонуклеиновой кислоты.
ООО «Медикал Геномикс» Лицензия № ЛО-69-01-002086 от 06.10.2017
Юр. адрес: г. Тверь, ул. Желябова, 48
ООО «Лаб-Трейдинг», ИНН: 6950225035, ОГРН: 1186952017053, КПП:695001001
Юр. адрес: г. Тверь, ул. 1-Я За Линией Октябрьской Ж/Д, 2, оф. 22
Таинственный код нашего генома
Расшифровка генетического код стала важным научным событием двадцатого века. Сейчас перед учеными появляются новые загадки о функционировании нашего генома.
Автор
Редакторы
Последовательность ДНК определяет строение белка с помощью триплетного генетического кода, в котором каждой аминокислоте соответствует три нуклеотида. Случайные мутации приводят к изменению последовательности нуклеотидов, в результате чего появляются новые варианты белков. Именно так до недавнего времени представляли себе ученые эволюцию белков. Но благодаря исследованиям последних лет оказалось, что помимо генетического кода есть и другие «коды», которые диктуют эволюции белков свои правила.
Одним из важных свойств генетического кода является его избыточность — каждая аминокислота, как правило, кодируется не одним, а 2–6 кодонами. Интересно, что при этом частота использования разных кодонов, отвечающих за одну и ту же аминокислоту, различается как в прокариотических, так и в эукариотических геномах [1]. У организмов с коротким жизненным циклом предпочтения одних кодонов другим связывают с необходимостью в увеличении эффективности транскрипции и стабильности мРНК [2], [3]. Однако в случае геномов млекопитающих такое объяснение подходит лишь для небольшого количества случаев, поэтому в последние годы ученые активно занимаются изучением особенностей геномов млекопитающих и причин предпочтительного использования тех или иных кодонов.
Важное значение в частоте использования кодонов играют транскрипционные факторы — к такому выводу пришла группа ученых из Университета Вашингтона под руководством Джона Стаматояннопоулоса (John A. Stamatoyannopoulos). В опубликованной в журнале Science статье обсуждается, как транскрипционные факторы могут управлять эволюцией белков посредством влияния на частоту использования кодонов [4].
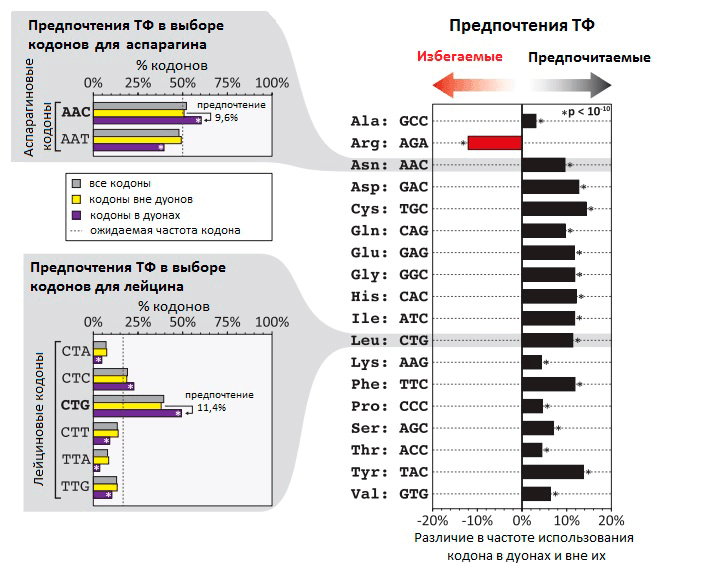
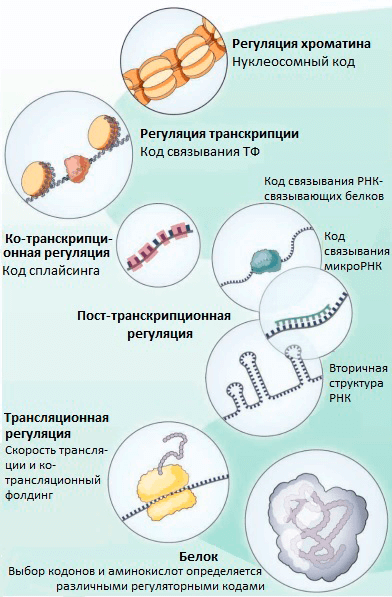
Транскрипционные факторы (ТФ) — это белки, регулирующие транскрипцию генов при связывании с ДНК. ТФ могут повышать транскрипцию или снижать ее, влияя, таким образом, на количество мРНК и белка, соответствующих определенному гену. Долгое время считалось, что ТФ связываются только в некодирующей (не содержащей генов) части ДНК. В своем новом исследовании группа Стаматояннопоулоса выяснила, что на самом деле во многих генах человека ТФ связываются с кодирующими последовательностями ДНК (т.е. с теми, которые являются частью генов). Так как эффективность связывания ТФ с ДНК зависит от того, какие именно нуклеотиды находятся в сайте связывания, ТФ могут снижать возможное разнообразие кодонов в местах своей посадки (рис. 1). При этом даже нейтральные с точки зрения белка мутации (те, при которых последовательность аминокислот не меняется благодаря избыточности генетического кода) могут изменять эффективность связывания ТФ с ДНК и становиться материалом для естественного отбора. Получается, что эволюция белков определяется не только хорошо изученным генетическим кодом, но и другим особенным кодом — «кодом связывания ТФ». Ранее были описаны и некоторые другие «регуляторные» коды, которые контролируют организацию хроматина [5], пространственную структуру и сплайсинг мРНК [5], [6], эффективность трансляции [7], ко-трансляционный фолдинг белков [8] (рис. 2). Все они могут влиять на предпочтительное использование тех или иных кодонов.
Рисунок 1. Неслучайная частота использования кодов в дуонах в местах связывания ТФ с ДНК. На гистограмме видно, что частота использования некоторых кодонов на 5–15% выше в дуонах, чем вне дуонов. В случае аргинина кодон AGA, напротив, гораздо реже встречается в дуонах, чем в других участках генома. В левой части рисунка — распределение частоты использования разных кодонов на примере кодонов для аспарагина и лейцина.
Насколько в геноме распространено применение дополнительных «регуляторных» кодов, которые перекрывают генетический код, и какое влияние они оказывают на эволюцию белков? Сотрудники лаборатории Стаматояннопоулоса попытались ответить на этот вопрос при исследовании «кода связывания ТФ». Чтобы выявить участки ДНК, связывающиеся с ТФ, они применили метод картирования с помощью дезоксирибонуклеазы I. Этот фермент разрушает одноцепочечные участки ДНК — если только они в этот момент не связаны с ТФ (в таком случае они сохранятся). Ученые исследовали 81 тип человеческих клеток, определив точные нуклеотидные последовательности связанных с ТФ участков генов. Оказалось, что приблизительно 14% кодонов в 86,9% генов человека связаны с различными транскрипционными факторами. В своей статье исследователи предлагают называть эти участки генов «дуонами», т.к. они кодируют два типа информации — информацию о белковой последовательности в виде генетического кода и информацию об экспрессии гена с помощью связывания ТФ. Для нормальной экспрессии гена необходимо связывание ДНК с ТФ, поэтому существуют определенные ограничения на использование различных кодонов, обусловленные строением ДНК-связывающего участка ТФ.
В геноме человека широко распространены однонуклеотидные полиморфизмы (single nucleotide polymorphisms, SNP) — различия последовательности гомологичных генов разных людей на один нуклеотид. Могут ли такие однонуклеотидные различия повлиять на эффективность связывания ТФ с ДНК? Чтобы узнать это, ученые из лаборатории Стаматояннопоулоса нашли на полученной ими карте дуонов почти 600 тыс. известных сайтов SNP, связанных с развитием какого-либо заболевания или проявлением определенного фенотипического признака. Оказалось, что 17,4% сайтов полиморфизма изменяют результаты картирования с помощью дезоксирибонуклеазы I, т.е. они, вероятно, снижают эффективность связывания ТФ с ДНК. Это изменение не зависит от того, является ли данный полиморфизм синонимичным или несинонимичным (т.е. влияет ли замена нуклеотида на замену аминокислоты в белке). Интересно, что значительная часть несинонимичных замен, хотя и приводит к изменению последовательности белка, не приводит к нарушению его функций. В этих случаях изменения нуклеотидной последовательности приводят только к нарушению связывания ТФ с ДНК. Эта находка поддерживает гипотезу о том, что SNP в кодирующей ДНК могут приводить к развитию заболеваний без влияния на функцию белка [9], [10]. Поэтому при изучении роли SNP в различных заболеваниях и при исследовании экзома необходимо учитывать весь спектр «регуляторных кодов», взаимодействующих с последовательностью гена.
«Регуляторные коды» далеко не всегда мирно и гармонично сосуществуют. В генах плодовой мушки Drosophila melanogaster ближе к концу экзонов наблюдается резкое снижение частоты использования оптимальных для трансляции кодонов и повышение частоты использования кодонов, которые облегчают сплайсинг мРНК [11]. Это показывает, что в ходе эволюции потребность в точном сплайсинге была выше, чем потребность в более эффективной трансляции. Также при исследовании дуонов и других ТФ-связывающих участков ДНК оказалось, что среди этих последовательностей нет стоп-кодонов.
Рисунок 2. «Тайные коды» нашего генома, которые определяют частоту использования кодонов и выбор аминокислот в эволюции белков, независимо от выполнения белком его функций
Что же может обеспечить взаимовыгодное соседство «регуляторных» и генетического кодов? Одним из ключевых ограничений для белок-кодирующих генов является то, что последовательность гена должна обеспечивать нормальный фолдинг кодируемого белка. Мутации, нарушающие правильную укладку, с большой вероятностью будут отсеяны как вредные. Можно предположить, что когда необходимость правильного фолдинга отсутствует (например, в неструктурированных белках [12]), белок-кодирующая последовательность может содержать большее количество регуляторных элементов для различных «регуляторных кодов». Действительно ли это так, помогут узнать дальнейшие исследования.
Несмотря на то, что в работе Стаматояннопоулоса и его коллег было сделано много интересных наблюдений о функционировании «кода связывания ТФ», некоторые вопросы остаются открытыми. Например, авторы статьи отмечают, что ТФ гораздо реже связываются с генами с высокой экспрессией, но не ясно, как ТФ при связывании с белок-кодирующими участками ДНК могут воздействовать на транскрипцию этих генов. Возможно, что связывание ТФ в данном случае вызывает активацию альтернативного промотора или соседнего гена, снижая таким образом экспрессию гена с ТФ-связывающей последовательностью. С другой стороны, этот эффект может быть связан с перестройкой хроматина, которая приводит к снижению экспрессии ряда генов.
Новые исследования помогут ученым лучше понять, как различные «регуляторные коды» взаимодействуют друг с другом и с генетическим кодом. Интересно узнать, всегда ли природа могла найти оптимальное решение при сочетании разных кодов, или иногда возникали противоречия, приводящие к неоптимальным или вредным последствиям. Например, может оказаться, что белок-кодирующие последовательности ДНК, которым «трудно справиться» с обилием и разнообразием регуляторных элементов, активно используются патогенами при инфицировании хозяина. Обнаружение перекрывающихся «регуляторных кодов» в нашем геноме открывает новые перспективы для интерпретации различий и особенностей в последовательностях ДНК и указывает на то, что исследование генетического кода еще не подошло к концу.
Перевод редакционной колонки журнала Science [13].