модификации гистонов гистоновый код
Купи книжку на Озоне и сдай экзамен!
В многоклеточных организмах существует специфический паттерн экспрессии генов, отвечающий за клеточную дифференцировку. Посттрансляционные модификации гистонов влияют на экспрессию генов, таким образом создавая гистоновый код. Эксперименты в области динамики модификаций гистонов показали большую разницу в кинетике между метилированием, фосфорилированием и ацетилированием, доказывая разные роли этих модификаций в эпигенетическом наследовании.
Тезисы статьи «Fast signals and slow marks: the dynamics of histone modifications», Teresa K. Barth and Axel Imhof
Эпигенетическое наследование
Эпигенетика – наследуемые изменения генной активности, которые не закодированы в последовательности ДНК.
Типы эпигенетических модификаций:
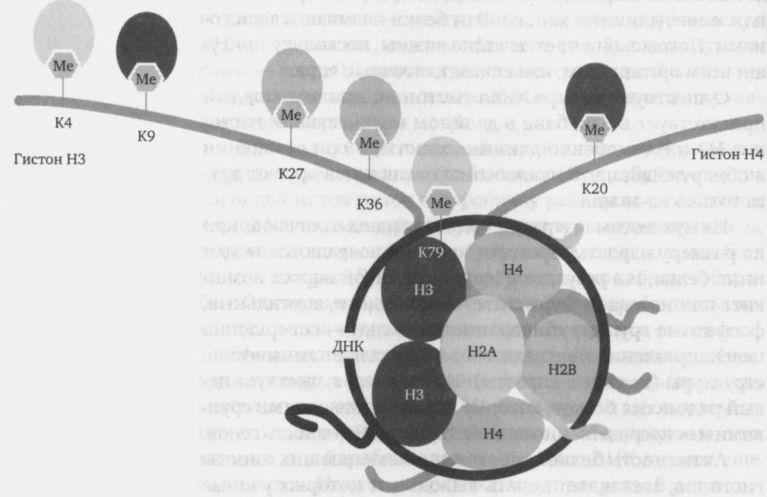
Гипотеза гистонового кода
Гистоновый код – гипотеза, предложенная Strahl и Allis в 2000, предполагает, что существуют модификации гистонов, которые могут приводить к активации либо репрессии транскрипции.
Модификации гистонов не имеют прямого влияния на структуру хроматина. Они либо понижают положительный заряд на хвостах гистонов, что приводит к их диссоциации от ДНК, либо способствуют связыванию белков, распознающими модифицированные гистоны. Например, хромодомен белка HP1 связывается с H3K9me. Подобный домен в белке Polycomb (Pc) распознает H3K27me.
Модификации на двух соседних аминокислотных остатках могут влиять друг на друга. Например, метилирование 9-ого лизина гистона Н3, который связывает белок HP1. В течение митоза и конденсации хроматина фосфорилируется 10-й серин, что приводит к снижению связывания HP1 с Н3K9me. Это связывание еще больше снижается, когда Н3 ацетилируется по 14-ому лизину. Различные модификации гистонов распознаются разными белками, имеющими специфические связывающие домены (такие как бромодомены и хромодомены). Эти белки могут иметь разнообразные функции, такие как рекрутирование других белков или ферментативную активность, таким образом выступая в качестве механизма перевода информации, закодированной в модификациях гистонов.
Требования к эпигенетическому коду
Результат модификаций гистонов
Гистоны синтезируются в цитоплазме, после чего транспортируются в ядро. Наиболее высокий уровень синтеза гистонов совпадает с S-фазой клеточного цикла, т.к. они необходимы клетке в этот период. Сразу после синтеза гистоны приобретают специфический модификационный паттерн и ассоциируются с шаперонами, которые облегчают их осаждение на ДНК.
Наиболее значительные изменения в структуре хроматина происходят во время транскрипции специфических генов, синтеза ДНК в течение S-фазы клеточного цикла и конденсации хромосом в течение митоза.
Ацетилирование
В новосинтезированных гистонах ацетилированы К5, К12 гистона Н4 и К18, К1 гистона Н3. В течение транспорта из цитоплазмы в ядро, гистоны приобретают дополнительные модификации (H3K9me, H3K56Ac).
Ацетилирование гистонов, как правило, ведет к активации транскрипции генов.
В транскрипционно активных областях хроматина высокое содержание моноацетилированных гистонов H3 и H4, что свидетельствует об их особой роли в процессе активации транскрипции. Моноцетилирование К6 – главная модификация гистона H4 в клетках животных. Удаление фермента, катализирующего модификацию H3K16 приводит к фрагментации ядра, что еще раз свидетельствует о важной роли этой модификации.
Ацетилированные гистоны располагаются в области промотеров генов. Ацетилирование гистонов происходит быстрее, чем метилирование.
Метилирование
Метилированные гистоны (за исключением H3K4me) располагаются по всей области генов.
Метилирование гистонов играет наиболее значительную роль в создании эпигенетической информации, в то время как остальные модификации имеют модулирующую функцию (например, могут иметь роль сигнальных молекул для приема внешнего сигнала хроматином).
Активно транскрибируемые районы генов: H3K4me2,3; H3K36me2,3
Репрессия транскрипции: H3K27me3; H4K20me3
Фосфорилирование
Фософорилирование гистонов совпадает с началом митоза, который начинается с фосфорилирования линкерного гистона H1. Хвосты (N-концевые части) коровых гистонов подвергаются фосфорилированию во время деления клетки (Т3, S10, S28 гистона Н3 и S1 гистона Н4).
Рис.1. Распределение модификаций гистонов в активных и «молчащих» генах.
Рис.2. Модификации гистонов в течение репликации.
Рис.3. Различные типы модификаций гистонов на эпигенетическом ландшафте Уэддингтона.
Гистоновый код
Модификации хроматина включают ковалентные посттрансляционные модификации торчащих амино-терминальных гистоновых «хвостов» путем добавления к ним ацетильных, метильных, фосфатных, убиквитиновых или других групп. Метильные модификации могут представлять собой моно-, ди-, или три-метилирование. Эти модификации составляют потенциальный «гистоновый код», лежащий в основе специфической хроматиновой структуры, которая, в свою очередь, влияет на экспрессию соседних генов. Так как хроматин состоит из плотно упакованных цепей ДНК, завернутых вокруг гистонов, паттерн укладки ДНК в хроматин несомненно лежит в основе изменений генной активности. Хотя гистоновые коды и хроматиновые структуры могут стабильно передаваться от родительской в дочерние клетки, механизмы, лежащие в основе репликации таких структур, поняты не полностью.
На основе некоторых из этих соображений была предложена более общая гипотеза, где HPTMs служат в качестве ядерного ассоциированного с ДНК пути проведения сигнала, подобного цитоплазматическому проведению сигнала, которое генерируется и воспроизводится в основном через фосфорилирование Ser/Thr ( Schreiber and Bernstein, 2002 ). В этой модели имеет место не строгий гистоновый код, а скорее узнавание и связывание НРТМ благодаря изобилию связывающих белок мотивов. Эта модель объясняет, каким образом любой сайт мог бы быть и активирующим, и репрессирующим и участвовать в более чем одном процессе, потому что различные связывающиеся эффекторные белки имеют сродство к одной и той же НРТМ для разных процессов.
Проведенные исследования (см. » Модификации гистонов «) ставят вопрос о том, существует ли «гистоновый код» или даже «эпигенетический код». Хотя эта теоретическая концепция оказалась весьма стимулирующей, и было показано, что в некоторых своих предсказаниях она правильна, вопрос о том, действительно ли существует некий код, остается в значительной степени открытым.
Для сравнения скажем, что генетический код оказался крайне полезным ввиду возможности делать предсказания на его основе и благодаря его почти полной универсальности. Он использует в основном «алфавит» из четырех оснований в ДНК (т.е. нуклеотидов), образуя в целом инвариантный и почти универсальный язык. В противоположность этому современные данные заставляют считать, что картины гистоновых модификаций значительно варьируют от организма к организму, особенно между низшими и высшими эукариотами, например дрожжами и человеком.
«Гистоновый код» или trans-эффекты ковалентных модификаций гистонов, потенциально может быть центральной эпигенетической функцией.
Резюме: Гистоновый код (histone code) [греч. histos — ткань; франц. code — код, шифр] — разнообразный набор модификаций (ацетилирование, фосфорилирование, метилирование) «хвостов» гистонов (см. Гистоны), расположенных на поверхности нуклеосом, в результате которого происходят изменения экспрессии генов, передающиеся по наследству. Модификации гистонов влияют на характер упаковки хроматиновой фибриллы, разрыхляя или, наоборот, уплотняя ее, что в свою очередь соответственно облегчает или затрудняет доступ к ДНК многочисленным регуляторным факторам и в значительной мере определяет функциональное состояние гена. Г.к. служит одним из основных эпигенетических механизмов, контролирующих включение или выключение генов и передачу программы этого контроля по наследству от клетки к клетке.
Гистоновый код: искусство упаковки с хвостами
Гистоновый код: искусство упаковки с хвостами
Разумеется, на берлинской конференции по эпигенетике я узнал много нового. Даже из докладов. Например, мне стало известно, что у многих белков есть хвост. У некоторых даже два. Это, разумеется, не отросток позвоночника, как у мышей или кошек, а конец или начало цепочки, из которой состоит белок. Хвост торчит из конструкции, получившейся в результате синтеза молекулы.
Конечно, можно посчитать, что природа пошутила, снабдив некоторые из своих кирпичиков хвостами. Однако в природе практически все имеет смысл, вот и хвосты белков не исключение — они играют решающую роль в программировании наследственного материала. Чтобы объяснить это нагляднее, мне придется уменьшиться в миллион раз и совершить путешествие в невообразимо миниатюрный наномир соматических клеток.
Внутри клетки кипит жизнь: там есть белковые фабрики, электростанции, клеточный скелет, множество снующих туда-сюда молекул-медиаторов и молекул-транспортеров, а также многое другое. Но в центре действия — неподвижное клеточное ядро, толстое и круглое, словно пчелиная матка в улье. Размер ядра — одна сотая миллиметра, и это самая крупная часть клетки. Через одну из многочисленных пор я попадаю внутрь ядра. Обычно этим путем наружу проникает транспортная РНК. Она доставляет на белковые фабрики считанные с ДНК «монтажные схемы».
У меня перехватывает дыхание: внутри ядра тоже повсюду снуют белки, оседающие в разных местах тонюсенькой ниточки. Белки участвуют в считывании генетического кода, а ниточка — не что иное, как одна из 46 молекул ДНК — хромосом, содержащих этот код. Толщина хромосомы — всего 0,3 нанометра, то есть треть одной миллионной миллиметра, зато длина ДНК в совокупности составляет легендарные два метра.
Если бы эти нити по всей своей длине беспорядочно переплетались, воцарился бы хаос. (Попробуйте-ка уложить два метра ниток в коробочку размером с клеточное ядро.) К счастью, существуют структуры, отвечающие за порядок: я вижу округлые образования из нескольких белков, на которые ДНК наматывается, словно кабель на барабан. Одновременно множество подобных барабанов связываются в цепочку, напоминающую жемчужное ожерелье.
Издалека это ожерелье выглядит очень изящно. И неудивительно, ведь поперечник нити — всего одиннадцать миллионных миллиметра. Но в некоторых местах заметны утолщения. Я подхожу поближе и обнаруживаю, что именно там барабаны вместе с нитью ДНК делают еще один виток. На этот раз они образуют спираль. В результате нить еще раз заметно укорачивается и утолщается, образуя 30-нанометровую фибриллу.
Это спирально закрученное переплетение белков и ДНК теперь в сто раз толще изначального наследственного вещества. Биологи называют такое переплетение хроматином — независимо от того, насколько плотно оно упаковано. В сильно скрученном состоянии оно называется гетерохроматином. Когда клетка находится в процессе деления, например, если ткань, в которую она входит, должна расти, гетерохроматин скручивается особенно плотно, чтобы отдельные хромосомы могли распутаться и распределиться по дочерним клеткам. Вернемся к многочисленным барабанам, на которые нить ДНК во многих местах наматывается в два-три оборота. Эти так называемые нуклеосомы на первый взгляд одинаковы. Они состоят из восьми шаровидных белков, из которых торчат более или менее длинные хвосты. Эти белки называются гистонами. Похоже, они чрезвычайно важны, поскольку присущи всем организмам, имеющим клеточные ядра.
Существует четыре типа гистонов, причем каждый присутствует в барабане в двойном количестве. У гистонов Н3 и Н4 особенно длинные хвосты, и при сравнении я обнаруживаю, что нуклеосомы отличаются друг от друга только из-за них.
На нуклеосомах в разных местах видны отличающиеся по размеру наросты. Время от времени появляются те или иные белки, и в результате их работы такой нарост возникает или исчезает. Ферменты — метильные, ацетильные, фосфатные группы, убиквитиновые белки — совершенно целенаправленно присоединяют или удаляют химические структуры (те самые наросты). Кроме того, существует целый ряд малых белков, которые связываются с этими группами и непосредственно воздействуют на активность генов.
Активность белков, постоянно изменяющих хвосты гистонов, заставляет делать выводы, от которых ученые отказывались всего 15 лет назад. Теперь это общепризнанное мнение: благодаря изменчивости гистоновых хвостов эпигенетический код может оказывать удивительно детальное, тонко дифференцированное и многоаспектное влияние на назначение и свойства клетки.
Заклинание звучит так: модификация гистонов. В зависимости от того, какой нарост и какой малый белок присоединяются к тому или иному участку хвоста, пространственная структура гистона строго определенным образом меняется. В результате нить ДНК либо плотнее, либо свободнее прилегает к барабану, так что ряду дополнительных белков, выполняющих важные функции, легче или труднее к ней присоединиться.
Модификация гистонов. Нуклеосома, на которую наматывается нить ДНК, состоит из восьми гистонов. На разных участках хвостов гистонов Н3 и Н4 ферменты могут прикреплять и снова удалять метильные группы. К метильным группам присоединяются малые белки, влияющие на генную регуляцию. Так как аналогичные процессы происходят и с другими химическими группами, у клетки множество возможностей варьировать активность того или иного участка ДНК.
Например, при помощи фермента клетка удаляет в одном месте или присоединяет в другом какое-либо химическое соединение, вследствие чего ДНК еще плотнее накручивается на свой «барабан». Это мгновенно выключает гены на данном участке. Но может случиться и так, что нить ДНК распускает кольца или вообще сматывается с катушки, что при определенных условиях сразу открывает целые группы генов для считывания, а следовательно, и для активации.
Одновременно нуклеосомы могут распадаться на составные части, чтобы снова собраться в катушку в совершенно другом участке генома. При этом они наматывают какой-либо участок ДНК особенно плотно и деактивируют его. Похоже, помимо этого структура нуклеосомы определяет, на каких именно участках хроматин уплотняется до состояния гетерохроматина. Там гены не считываются ни при каких условиях.
Белковые структуры, расположенные вокруг ДНК, «гораздо динамичнее, чем мы предполагали раньше», считает Стивен Хеникофф из Высшей медицинской школы имени Говарда (Сиэтл, США). По его словам, хвостатые белки образуют в наследственном материале настоящий гистоновый код. Пока еще точно не известно, как именно протекают все эти процессы, но совершенно очевидно: гистоновый код позволяет каждой клетке выбирать одну из множества различных программ генной регуляции, а также создавать новые программы и сохранять их на ближайшее будущее.
В клеточном ядре очень много нуклеосом. Каждая из них выполняет отдельную крохотную задачу — контролирует обвивающийся вокруг нее участок ДНК длиной примерно в 150 генных букв. Но все вместе нуклеосомы помогают работе клетки. Без потрясающей изменчивости крохотных белковых барабанов клетки не смогли бы правильно прочитать свой генетический код, не говоря уже о правильном упорядочении и осмысленном использовании информации.
«Если ДНК — единица хранения генетической информации, то нуклеосома представляет собой единицу хранения эпигенетической информации; она способна реагировать на сигналы из окружающей среды и влиять на способ функционирования генов», — уверен Томас Йенувайн из Фрайбурга.
Читайте также
Главное – это верить в исцеление и искусство врача
Главное – это верить в исцеление и искусство врача Наиболее существенным условием со стороны самого больного при лечении внушением является вера в действительность какого-либо внушения или симпатического средства, приводящая к ожиданию грядущего исцеления. Без этой
10.5. Мифология и искусство в русле культурной антропологии
10.5. Мифология и искусство в русле культурной антропологии Наличие общего в различных областях культуры (религии, мифологии, искусстве, мировоззрении) у самых разных народов указывает на универсальные аспекты человеческой психики, на их филогенетические
Искусство
Искусство Искусство – важнейшая составляющая человеческой деятельности. Это область исследований множества наук – социологии, психологии, культурологии, искусствоведения. Существует несметное число теорий искусства, рассматриваемых в этих науках, которые
8.7. Искусство как спасительный создатель альтруистически-героических установок
8.7. Искусство как спасительный создатель альтруистически-героических установок Стихи и легенды играли до появления письменности гораздо более жизнеспасающую роль, чем ныне. Само существование скальдов и бардов не давало убегать с поля боя. Воин, знающий, что он будет
Искусство немножко отличаться
Искусство немножко отличаться Если только при клонировании не случится генетической ошибки, потомок бделлоидной коловратки будет идентичен своей матери. Человеческий же детеныш не идентичен своим родителям — это очевидное следствие полового размножения. По мнению
18. ИСКУССТВО БЫТЬ ЗДОРОВЫМ (8-й кл.)
18. ИСКУССТВО БЫТЬ ЗДОРОВЫМ (8-й кл.) ЦЕЛИ:1) рассказать учащимся о тех свойствах и качествах человеческого организма, которые в обыденной жизни как бы дремлют, а проявляются лишь в экстремальных состояниях;2) помочь учащимся раскрыть свои внутренние резервы.СОДЕРЖАНИЕ1.
СОДЕРЖАНИЕ
Обзор
Регуляция транскрипции генома контролируется в первую очередь на стадии преинициации путем связывания основных белков транскрипционного аппарата (а именно, РНК-полимеразы, факторов транскрипции, активаторов и репрессоров) с основной последовательностью промотора в кодирующей области ДНК. Однако ДНК плотно упакована в ядре с помощью упаковывающих белков, в основном гистоновых белков, с образованием повторяющихся единиц нуклеосом, которые затем связываются вместе, образуя конденсированную структуру хроматина. Такая конденсированная структура перекрывает многие регуляторные области ДНК, не позволяя им взаимодействовать с белками транскрипционного аппарата и регулировать экспрессию генов. Чтобы преодолеть эту проблему и обеспечить динамический доступ к конденсированной ДНК, процесс, известный как ремоделирование хроматина, изменяет архитектуру нуклеосом, чтобы обнажить или скрыть области ДНК для регуляции транскрипции.
Классификация
Доступ к нуклеосомной ДНК регулируется двумя основными классами белковых комплексов:
Ковалентные модифицирующие гистоны комплексы
Известные модификации
Хорошо охарактеризованные модификации гистонов включают:
Известно, что остатки лизина и аргинина метилированы. Метилированные лизины являются наиболее понятными метками гистонового кода, поскольку конкретный метилированный лизин хорошо согласуется с состояниями экспрессии генов. Метилирование лизинов H3K4 и H3K36 коррелирует с активацией транскрипции, тогда как деметилирование H3K4 коррелирует с молчанием геномной области. Метилирование лизинов H3K9 и H3K27 коррелирует с репрессией транскрипции. В частности, H3K9me3 сильно коррелирует с конститутивным гетерохроматином.
Ацетилирование имеет тенденцию определять «открытость» хроматина, поскольку ацетилированные гистоны не могут упаковываться вместе так же хорошо, как деацетилированные гистоны.
Гипотеза гистонового кода
Критическая концепция гипотезы гистонового кода состоит в том, что модификации гистонов служат для рекрутирования других белков путем специфического распознавания модифицированного гистона через белковые домены, специализированные для таких целей, а не посредством простой стабилизации или дестабилизации взаимодействия между гистоном и лежащей в основе ДНК. Эти рекрутированные белки затем действуют, активно изменяя структуру хроматина или способствуя транскрипции.
Краткое изложение гистонового кода для статуса экспрессии генов приведено ниже (номенклатура гистонов описана здесь ):
| Тип модификации | Гистон | ||||||
|---|---|---|---|---|---|---|---|
| H3K4 | H3K9 | H3K14 | H3K27 | H3K79 | H4K20 | H2BK5 | |
| моно- метилирование | активация | активация | активация | активация | активация | активация | |
| диметилирование | подавление | подавление | активация | ||||
| триметилирование | активация | подавление | подавление | активация, подавление | подавление | ||
| ацетилирование | активация | активация | |||||
АТФ-зависимое ремоделирование хроматина
АТФ-зависимые комплексы ремоделирования хроматина регулируют экспрессию генов путем перемещения, выброса или реструктуризации нуклеосом. Эти белковые комплексы имеют общий АТФазный домен, и энергия от гидролиза АТФ позволяет этим ремоделирующим комплексам перемещать нуклеосомы (часто называемое «скольжение нуклеосом») вдоль ДНК, выталкивать или собирать гистоны на / из ДНК или облегчать обмен гистона. варианты, и, таким образом, создавая свободные от нуклеосом участки ДНК для активации генов. Кроме того, некоторые ремоделеры обладают активностью транслокации ДНК для выполнения определенных задач ремоделирования.
Все АТФ-зависимые комплексы ремоделирования хроматина содержат субъединицу АТФазы, которая принадлежит к суперсемейству белков SNF2. В связи с идентичностью субъединицы для этих белков были классифицированы две основные группы. Они известны как группа SWI2 / SNF2 и группа имитации SWI (ISWI). Третий класс АТФ-зависимых комплексов, который был недавно описан, содержит Snf2-подобную АТФазу, а также демонстрирует деацетилазную активность.
Известные комплексы ремоделирования хроматина
Конкретные функции
Значение
В нормальных биологических процессах
Ремоделирование хроматина играет центральную роль в регуляции экспрессии генов, обеспечивая аппарату транскрипции динамический доступ к иначе плотно упакованному геному. Кроме того, перемещение нуклеосом с помощью ремоделеров хроматина важно для нескольких важных биологических процессов, включая сборку и сегрегацию хромосом, репликацию и репарацию ДНК, эмбриональное развитие и плюрипотентность, а также прогрессию клеточного цикла. Нарушение регуляции ремоделирования хроматина вызывает потерю регуляции транскрипции в этих критических контрольных точках, необходимых для правильных клеточных функций, и, таким образом, вызывает различные болезненные синдромы, включая рак.
Ответ на повреждение ДНК
За быстрой начальной релаксацией хроматина при повреждении ДНК (с быстрым инициированием репарации ДНК) следует медленная повторная конденсация, при которой хроматин восстанавливает состояние уплотнения, близкое к своему уровню до повреждения, через
Геномика рака
Лечебное вмешательство
В настоящее время лидерами среди кандидатов на роль новых лекарственных препаратов являются гистоновые лизинметилтрансферазы (KMT) и протеин-аргинин-метилтрансферазы (PRMT).
Синдромы других заболеваний
Старение
Эпигенетика: теоретические аспекты и практическое значение
В данной статье освещаются современные представления о эпигенетике как новой науке, механизмах эпигенетической регуляции и ее нарушениях, приводящих к развитию заболеваний.
This article highlights the modern views on epigenetics as a new science, the mechanisms of epigenetic regulation and their disorders, leading to the development of diseases.
Эпигенетика — сравнительно недавнее направление биологической науки и пока не так широко известно, как генетика. Под ней понимают раздел генетики, который изучает наследуемые изменения активности генов во время развития организма или деления клеток.
Эпигенетические изменения не сопровождаются перестановкой последовательности нуклеотидов в дезоксирибонуклеиновой кислоте (ДНК).
В организме существуют различные регуляторные элементы в самом геноме, которые контролируют работу генов, в том числе в зависимости от внутренних и внешних факторов. Долгое время эпигенетику не признавали, т. к. было мало информации о природе эпигенетических сигналов и механизмах их реализации.
Структура генома человека
В 2002 г. в результате многолетних усилий большого числа ученых разных стран закончена расшифровка строения наследственного аппарата человека, который заключен в главной молекуле ДНК. Это одно из выдающихся достижений биологии начала ХХI века.
ДНК, в которой находится вся наследственная информация о данном организме, называется геномом. Гены — это отдельные участки, занимающие очень небольшую часть генома, но при этом составляют его основу. Каждый ген отвечает за передачу в организме человека данных о строении рибонуклеиновой кислоты (РНК) и белка. Структуры, которые передают наследственную информацию, называют кодирующими последовательностями. В результате проекта «Геном» были получены данные, согласно которым геном человека оценивался в более чем 30 000 генов. В настоящее время, в связи с появлением новых результатов масс-спектрометрии, геном предположительно насчитывает около 19 000 генов [1].
Генетическая информация каждого человека содержится в ядре клетки и расположена в особых структурах, получивших название хромосомы. Каждая соматическая клетка содержит два полных набора (диплоидный) хромосом. В каждом единичном наборе (гаплоидном) присутствует 23 хромосомы — 22 обычные (аутосомы) и по одной половой хромосоме — Х или Y.
Молекулы ДНК, содержащиеся во всех хромосомах каждой клетки человека, представляют собой две полимерные цепи, закрученные в правильную двойную спираль.
Обе цепи удерживают друг друга четырьмя основаниями: аденин (А), цитозин (Ц), гуанин (Г) и тиамин (Т). Причем основание А на одной цепочке может соединиться только с основанием Т на другой цепочке и аналогично основание Г может соединяться с основанием Ц. Это называется принципом спаривания оснований. При других вариантах спаривание нарушает всю целостность ДНК.
ДНК существует в виде тесного комплекса со специализированными белками, и вместе они составляют хроматин.
Гистоны — это нуклеопротеины, основная составляющая хроматина. Им свойственно образование новых веществ путем присоединения двух структурных элементов в комплекс (димер), что является особенностью для последующей эпигенетической модификации и регуляции.
ДНК, хранящая генетическую информацию, при каждом клеточном делении самовоспроизводится (удваивается), т. е. снимает с самой себя точные копии (репликация). Во время клеточного деления связи между двумя цепями двойной спирали ДНК разрушаются и нити спирали разделяются. Затем на каждой из них строится дочерняя цепь ДНК. В результате молекула ДНК удваивается, образуются дочерние клетки.
ДНК служит матрицей, на которой происходит синтез разных РНК (транскрипция). Этот процесс (репликация и транскрипция) осуществляется в ядрах клеток, а начинается он с области гена, называемой промотором, на котором связываются белковые комплексы, копирующие ДНК для формирования матричной РНК (мРНК).
В свою очередь последняя служит не только носителем ДНК-информации, но и переносчиком этой информации для синтеза белковых молекул на рибосомах (процесс трансляции).
В настоящее время известно, что зоны гена человека, кодирующие белки (экзоны), занимают лишь 1,5% генома [2]. Большая часть генома не имеет отношения к генам и инертна в плане передачи информации. Выявленные зоны гена, не кодирующие белки, называются интронами.
Первая копия мРНК, полученная с ДНК, содержит в себе весь набор экзонов и интронов. После этого специализированные белковые комплексы удаляют все последовательности интронов и соединяют друг с другом экзоны. Этот процесс редактирования называется сплайсингом.
Эпигенетика объясняет один из механизмов, с помощью которого клетка способна контролировать синтез производимого ею белка, определяя в первую очередь, сколько копий мРНК можно получить с ДНК.
Итак, геном — это не застывшая часть ДНК, а динамическая структура, хранилище информации, которую нельзя свести к одним генам.
Развитие и функционирование отдельных клеток и организма в целом не запрограммированы автоматически в одном геноме, но зависят от множества различных внутренних и внешних факторов. По мере накопления знаний выясняется, что в самом геноме существуют множественные регуляторные элементы, которые контролируют работу генов. Сейчас это находит подтверждение во множестве экспериментальных исследований на животных [3].
При делении во время митоза дочерние клетки могут наследовать от родительских не только прямую генетическую информацию в виде новой копии всех генов, но и определенный уровень их активности. Такой тип наследования генетической информации получил название эпигенетического наследования.
Эпигенетические механизмы регуляции генов
Предметом эпигенетики является изучение наследования активности генов, не связанной с изменением первичной структуры входящей в их состав ДНК. Эпигенетические изменения направлены на адаптацию организма к изменяющимся условиям его существования.
Впервые термин «эпигенетика» предложил английский генетик Waddington в 1942 г. Разница между генетическими и эпигенетическими механизмами наследования заключается в стабильности и воспроизводимости эффектов [4].
Генетические признаки фиксируются неограниченное число, пока в гене не возникает мутация. Эпигенетические модификации обычно отображаются в клетках в пределах жизни одного поколения организма. Когда данные изменения передаются следующим поколениям, то они могут воспроизводиться в 3–4 генерациях, а затем, если стимулирующий фактор пропадает, эти преобразования исчезают.
Молекулярная основа эпигенетики характеризуется модификацией генетического аппарата, т. е. активации и репрессии генов, не затрагивающих первичную последовательность нуклеотидов ДНК.
Эпигенетическая регуляция генов осуществляется на уровне траскрипции (время и характер транскрипции гена), при отборе зрелых мРНК для транспорта их в цитоплазму, при селекции мРНК в цитоплазме для трансляции на рибосомах, дестабилизации определенных типов мРНК в цитоплазме, избирательной активации, инактивации молекул белков после их синтеза.
Совокупность эпигенетических маркеров представляет собой эпигеном. Эпигенетические преобразования могут влиять на фенотип.
Эпигенетика играет важную роль в функционировании здоровых клеток, обеспечивая активацию и репрессию генов, в контроле транспозонов, т. е. участков ДНК, способных перемещаться внутри генома, а также в обмене генетического материала в хромосомах [5].
Эпигенетические механизмы участвуют в геномном импритинге (отпечаток) — процессе, при котором экспрессия определенных генов осуществляется в зависимости от того, от какого родителя поступили аллели. Импритинг реализуется через процесс метилирования ДНК в промоторах, в результате чего транскрипция гена блокируется.
Эпигенетические механизмы обеспечивают запуск процессов в хроматине через модификации гистонов и метилирование ДНК. За последние два десятилетия существенно изменились представления о механизмах регуляции транскрипции эукариот. Классическая модель предполагала, что уровень экспрессии определяется транскрипционными факторами, связывающимися с регуляторными областями гена, которые инициируют синтез матричной РНК. Гистонам и негистоновым белкам отводилась роль пассивной упаковочной структуры для обеспечения компактной укладки ДНК в ядре.
В последующих исследованиях была показана роль гистонов в регуляции трансляции. Был обнаружен так называемый гистоновый код, т. е. модификация гистонов, неодинаковая в разных районах генома. Видоизмененные гистоновые коды могут приводить к активизации и репрессии генов [6].
Модификациям подвергаются различные части структуры генома. К концевым остаткам могут присоединяться метильные, ацетильные, фосфатные группы и более крупные белковые молекулы.
Все модификации являются обратимыми и для каждой существуют ферменты, которые ее устанавливают или удаляют.
Метилирование ДНК
У млекопитающих метилирование ДНК (эпигенетический механизм) было изучено раньше других. Показано, что он коррелирует с репрессией генов. Экспериментальные данные показывают, что метилирование ДНК является защитным механизмом, подавляющим значительную часть генома чужеродной природы (вирусы и др.).
Метилирование ДНК в клетке контролирует все генетические процессы: репликацию, репарацию, рекомбинацию, транскрипцию, инактивацию Х-хромосомы. Метильные группы нарушают ДНК-белковое взаимодействие, препятствуя связыванию транскрипционных факторов. Метилирование ДНК влияет на структуру хроматина, блокирует транскрипционные репрессоры [7].
Действительно, повышение уровня метилирования ДНК коррелирует с относительным увеличением содержания некодирующей и повторяющейся ДНК в геномах высших эукариот. Экспериментальные данные показывают, что это происходит потому, что метилирование ДНК служит главным образом как защитный механизм, чтобы подавлять значительную часть генома чужеродного происхождения (реплицированные перемещающиеся элементы, вирусные последовательности, другие повторяющиеся последовательности).
Профиль метилирования — активирование или угнетение — меняется в зависимости от средовых факторов. Влияние метилирования ДНК на структуру хроматина имеет большое значение для развития и функционирования здорового организма, чтобы подавлять значительную часть генома чужеродного происхождения, т. е. реплицированные перемещающиеся элементы, вирусные и другие повторяющиеся последовательности.
Метилирование ДНК происходит путем обратимой химической реакции азотистого основания — цитозина, в результате чего метильная группа СН3 присоединяется к углероду с образованием метилцитозина. Этот процесс катализируется ферментами ДНК-метилтрансферазами. Для метилирования цитозина необходим гуанин, в результате образуется два нуклеотида, разделенные фосфатом (СрG).
Скопление неактивных последовательностей СрG называется островками СрG. Последние представлены в геноме неравномерно [8]. Большинство из них выявляются в промоторах генов. Метилирование ДНК происходит в промоторах генов, в транскрибируемых участках, а также в межгенных пространствах.
Гиперметилированные островки вызывают инактивацию гена, что нарушает взаимодействие регуляторных белков с промоторами.
Метилирование ДНК оказывает огромное влияние на экспрессию генов и, в конечном счете, на функцию клеток, тканей и организма в целом. Установлена прямая зависимость между высоким уровнем метилирования ДНК и количеством репрессированных генов.
Удаление метильных групп из ДНК в результате отсутствия метилазной активности (пассивное деметилирование) реализуется после репликации ДНК. При активном деметилировании участвует ферментативная система, превращающая 5-метилцитозин в цитозин независимо от репликации. Профиль метилирования меняется в зависимости от средовых факторов, в которых находится клетка.
Утрата способности поддерживать метилирование ДНК может приводить к иммунодефициту, злокачественным опухолям и другим заболеваниям [9].
Долгое время механизм и ферменты, вовлеченные в процесс активного деметилирования ДНК, оставались неизвестными.
Ацетилирование гистонов
Существует большое число посттрансляционных модификаций гистонов, которые формируют хроматин. В 1960-е годы Винсент Олфри идентифицировал ацетилирование и фосфорилирование гистонов из многих эукариот [8].
Ферменты ацетилирования и деацетилирования (ацетилтрансферазы) гистонов играют роль в ходе транскрипции. Эти ферменты катализируют ацетилирование локальных гистонов. Деацетилазы гистонов репрессируют транскрипцию.
Эффект ацетилирования это ослабление связи между ДНК и гистонами из-за изменения заряда, в результате чего хроматин становится доступным для факторов транскрипции.
Ацетилирование представляет собой присоединение химической ацетил-группы (аминокислоты лизин) на свободный участок гистона. Как и метилирование ДНК, ацетилирование лизина представляет собой эпигенетический механизм для изменения экспрессии генов, не влияющих на исходную последовательность генов. Шаблон, по которому происходят модификации ядерных белков, стали называть гистоновым кодом.
Гистоновые модификации принципиально отличаются от метилирования ДНК. Метилирование ДНК представляет собой очень стабильное эпигенетическое вмешательство, которое чаще закрепляется в большинстве случаев.
Подавляющее большинство гистоновых модификаций более вариативно. Они влияют на регуляцию экспрессии генов, поддержание структуры хроматина, дифференциацию клеток, канцерогенез, развитие генетических заболеваний, старение, репарацию ДНК, репликацию, трансляцию. Если гистоновые модификации идут на пользу клетки, то они могут продолжаться довольно долго [8].
Одним из механизмов взаимодействия между цитоплазмой и ядром является фосфорилирование и/или дефосфорилирование транскрипционных факторов. Гистоны были одними из первых белков, фосфорилирование которых было обнаружено. Это осуществляется с помощью протеинкиназ.
Под контролем фосфорилируемых транскрипционных факторов находятся гены, в том числе гены, регулирующие пролиферацию клеток. При подобных модификациях в молекулах хромосомных белков происходят структурные изменения, которые приводят к функциональным изменениям хроматина.
Помимо описанных выше посттрансляционных модификаций гистонов имеются более крупные белки, такие как убиквитин, SUMO и др., которые могут присоединяться с помощью ковалентной связи к боковым аминогруппам белка-мишени, оказывая воздействие на их активность.
Эпигенетические изменения могут передаваться по наследству (трансгенеративная эпигенетическая наследственность). Однако в отличие от генетической информации, эпигенетические изменения могут воспроизводиться в 3–4 поколениях, а при отсутствии фактора, стимулирующего эти изменения, исчезают. Передача эпигенетической информации происходит в процессе мейоза (деления ядра клетки с уменьшением числа хромосом вдвое) или митоза (деления клеток).
Модификации гистонов играют фундаментальную роль в нормальных процессах и при заболеваниях.
Регуляторные РНК
Молекулы РНК выполняют в клетке множество функций. Одной из них является регуляция экспрессии генов. За эту функцию отвечают регуляторные РНК, к которым относятся антисмысловые РНК (aRNA), микроРНК (miRNA) и малые интерферирующие РНК (siRNA)
Механизм действия разных регуляторных РНК схож и заключается в подавлении экспрессии генов, реализующейся путем комплементарного присоединения регуляторной РНК к мРНК, с образованием двухцепочечной молекулы (дцРНК). Само по себе образование дцРНК приводит к нарушению связывания мРНК с рибосомой или другими регуляторными факторами, подавляя трансляцию. Также после образования дуплекса возможно проявление феномена РНК-интерференции — фермент Dicer, обнаружив в клетке двухцепочечную РНК, «разрезает» ее на фрагменты. Одна из цепей такого фрагмента (siRNA) связывается комплексом белков RISC (RNA-induced silencing complex) [10].
В результате деятельности RISC одноцепочечный фрагмент РНК соединяется с комплементарной последовательностью молекулы мРНК и вызывает разрезание мРНК белком семейства Argonaute. Данные события приводят к подавлению экспрессии соответствующего гена.
Физиологические функции регуляторных РНК разнообразны — они выступают основными небелковыми регуляторами онтогенеза, дополняют «классическую» схему регуляции генов.
Геномный импритинг
Человек обладает двумя копиями каждого гена, один из которых унаследован от матери, другой от отца. Обе копии каждого гена имеют возможность быть активной в любой клетке. Геномный импритинг это эпигенетически избирательная экспрессия только одного из аллельных генов, наследуемых от родителей. Геномный импритинг затрагивает и мужское и женское потомство. Так, импритингованный ген, активный на материнской хромосоме, будет активным на материнской хромосоме и «молчащим» на отцовской у всех детей мужского и женского пола. Гены, подверженные геномному импритингу, в основном кодируют факторы, регулирующие эмбриональный и неонатальный рост [11].
Импритинг представляет сложную систему, которая может ломаться. Импритинг наблюдается у многих больных с хромосомными делециями (утраты части хромосом). Известны заболевания, которые у человека возникают в связи с нарушением функционирования механизма импритинга.
Прионы
В последние десятилетие внимание привлечено к прионам, белкам, которые могут вызывать наследуемые фенотипические изменения, не изменяя нуклеотидной последовательности ДНК. У млекопитающих прионный белок расположен на поверхности клеток. При определенных условиях нормальная форма прионов может изменяться, что модулирует активность этого белка.
Викнер выразил уверенность в том, что этот класс белков является одним из многих, которые составляют новую группу эпигенетических механизмов, требующих дальнейшего изучения. Он может находиться в нормальном состоянии, а в измененном состоянии прионные белки могут распространяться, т. е. стать инфекционными [12].
Первоначально прионы были открыты как инфекционные агенты нового типа, но сейчас считают, что они представляют собой феномен общебиологический и являются носителями информации нового типа, хранимой в конформации белка. Феномен прионов лежит в основе эпигенетической наследственности и регуляции экспрессии генов на посттрансляционном уровне.
Эпигенетика в практической медицине
Эпигенетические модификации контролируют все стадии развития и функциональную активность клеток. Нарушение механизмов эпигенетической регуляции напрямую или косвенно связано с множеством заболеваний.
К заболеваниям с эпигенетической этиологией относят болезни импринтинга, которые в свою очередь делятся на генные и хромосомные, всего в настоящее время насчитывают 24 нозологии.
При болезнях генного импринтинга наблюдается моноаллельная экспрессия в локусах хромосом одного из родителей. Причиной являются точечные мутации в генах, дифференцированно экспрессирующихся в зависимости от материнского и отцовского происхождения и приводящих к специфическому метилированию цитозиновых оснований в молекуле ДНК. К ним относят: синдром Прадера–Вилли (делеция в отцовской хромосоме 15) — проявляется черепно-лицевым дисморфизмом, низким ростом, ожирением, мышечной гипотонией, гипогонадизмом, гипопигментацией и задержкой умственного развития; синдром Ангельмана (делеция критического района, находящегося в 15-й материнской хромосоме), основными признаками которого являются микробрахицефалия, увеличенная нижняя челюсть, выступающий язык, макростомия, редкие зубы, гипопигментация; синдром Беквитта–Видемана (нарушение метилирования в коротком плече 11-й хромосомы), проявляющийся классической триадой, включающей макросомию, омфалоцеле макроглоссию и др. [13].
К числу важнейших факторов, влияющих на эпигеном, относятся питание, физическая активность, токсины, вирусы, ионизирующая радиация и др. Особенно чувствительным периодом к изменению эпигенома является внутриутробный период (особенно охватывающий два месяца после зачатия) и первые три месяца после рождения. В период раннего эмбриогенеза геном удаляет большую часть эпигенетических модификаций, полученных от предыдущих поколений. Но процесс репрограммирования продолжается в течение всей жизни [14].
К заболеваниям, где нарушение генной регуляции является частью патогенеза, можно отнести некоторые виды опухолей, сахарный диабет, ожирение, бронхиальную астму, различные дегенеративные и другие болезни [15, 16].
Эпигоном при раке характеризуется глобальными изменениями в метилировании ДНК, модификации гистонов, а также изменением профиля экспрессии хроматин-модифицирующих ферментов.
Опухолевые процессы характеризуются инактивацией посредством гиперметилирования ключевых генов-супрессоров и посредством гипометилирования активацией целого ряда онкогенов, факторов роста (IGF2, TGF) и мобильных повторяющихся элементов, расположенных в районах гетерохроматина [17].
Так, в 19% случаев гипернефроидные опухоли почки ДНК островков СрG была гиперметилированной, а при раке груди и немелкоклеточной карциноме легких выявлена взаимосвязь между уровнями гистонового ацетилирования и экспрессией супрессора новообразований — чем ниже уровни ацетилирования, тем слабее экспрессия гена.
В настоящее время уже разработаны и внедрены в практику противоопухолевые лекарственные препараты, основанные на подавлении активности ДНК-метилтрансфераз, что приводит к снижению метилирования ДНК, активации генов-супрессоров опухолевого роста и замедлению пролиферации опухолевых клеток. Так, для лечения миелодиспластического синдрома в комплексной терапии применяют препараты децитабин (Decitabine) и азацитидин (Azacitidine) [18]. С 2015 г. для лечения множественной миеломы в сочетании с классической химиотерапией применяют панобиностат (Panibinostat), являющийся ингибитором гистоновой деацитилазы [19]. Данные препараты по данным клинических исследований оказывают выраженный положительный эффект на уровень выживаемости и качество жизни пациентов.
Изменения экспрессии тех или иных генов могут происходить и в результате действия на клетку факторов внешней среды. В развитии сахарного диабета 2-го типа и ожирения играет роль так называемая «гипотеза экономного фенотипа», согласно которой недостаток питательных веществ в процессе эмбрионального развития приводит к развитию патологического фенотипа [20]. На моделях животных был выявлен участок ДНК (локус Pdx1), в котором под влиянием недостаточности питания снижался уровень ацетилирования гистонов, при этом наблюдались замедление деления и нарушения дифференцировки B-клеток островков Лангерганса и развития состояния, схожего с сахарным диабетом 2-го типа [21].
Активно развиваются и диагностические возможности эпигенетики. Появляются новые технологии, способные анализировать эпигенетические изменения (уровень метилирования ДНК, экспрессию микроРНК, посттрансляционные модификации гистонов и др.), такие как иммунопреципитация хроматина (CHIP), проточная цитометрия и лазерное сканирование, что дает основания полагать, что в ближайшее время будут выявлены биомаркеры для изучения нейродегенеративных заболеваний, редких, многофакторных болезней и злокачественных новообразований и внедрены в качестве методов лабораторной диагностики [22].
Итак, в настоящее время эпигенетика бурно развивается. С ней связывают прогресс в биологии и медицине.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва