метастазы в подвздошные лимфоузлы код по мкб
Метастазы в подвздошные лимфоузлы код по мкб
Наряду с первичными опухолями лимфоидной ткани (злокачественные лимфомы) весьма значительную группу составляют метастатические поражения лимфатических узлов шеи. Наиболее часто источником метастазов бывает плоскоклеточный рак слизистой оболочки верхних дыхательных путей и верхней части ЖКТ.
Кроме того, иногда встречаются метастазы опухолей редких гистологических типов, а также опухолей, локализующихся вне области головы и шеи. В особую форму выделяют метастазы в шейные лимфатические узлы при неустановленной первичной опухоли.
Лимфогенное распространение плоскоклеточного рака происходит при инвазивном росте первичной опухоли и проникновении ее клеток в лимфатические сосуды. Эти клетки затем через приносящие лимфатические сосуды достигают следующей группы лимфатических узлов. Лишь небольшой части опухолевых клеток удается избежать воздействия местных факторов иммунитета.
Эти клетки обычно пролиферируют в субкапсулярных синусах лимфатических узлов, прежде чем превратиться в микрометастазы (менее 3 мм), однако клинические признаки поражения на этой стадии еще отсутствуют. По мере дальнейшей пролиферации опухолевых клеток образуются макрометастазы с экстракапсулярной и экстранодальной экспансией опухоли и продолжается лимфогенное и гематогенное распространение опухоли.
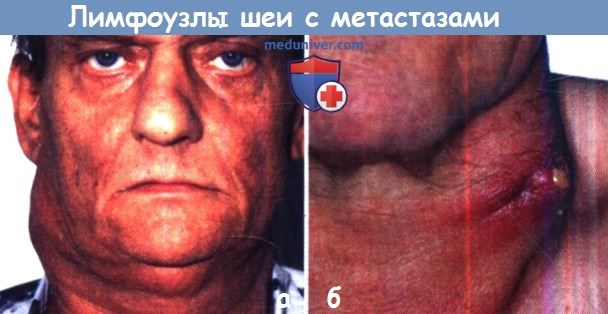
б Изъязвление пораженного метастазами лимфатического узла характеризуется появлением геморрагического отделяемого и часто воспалительной реакцией со стороны окружающей кожи.
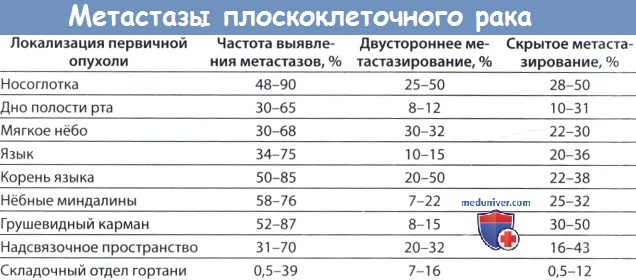
Вероятность лимфогенного распространения рака области головы и шеи зависит от локализации первичной опухоли и плотности лимфатической сосудистой сети. Вот почему, например, рак носоглотки и нёбной миндалины чаще дает метастазы, чем рак голосовой складки и гортаноглотки. Вероятность метастазирования зависит также от размеров первичной опухоли и глубины ее инвазии, степени дифференцировки (гистологическая градация I—IV), признаков наличия опухолевых клеток в лимфатических сосудах (карциноматозный лимфангиоз) и прорастания опухоли в оболочку нервов.
Возможно также, особенно при срединной локализации опухоли (например, рака носоглотки, корня языка, нёба, заперстневидного пространства) и при прогрессирующей опухолевой экспансии, двустороннее и перекрестное (в контралатеральные лимфатические узлы) метастазирование.
Лимфогенное распространение опухоли характеризуют с помощью классификации TNM, предложенной Американской объединенной комиссией по борьбе с раком и Американским противораковым союзом. Наряду с критерием Т, характеризующим степень распространения первичной опухоли, и M, отражающим наличие или отсутствие отдаленных метастазов, в классификации учитывается также состояние лимфатических узлов, наличие в них метастазов и степень распространения их по лимфатической системе (критерий N).
Номенклатура и топография шейных и лицевых лимфатических узлов была неоднократно модифицирована на основании результатов изучения особенностей метастазирования опухолей головы и шеи в зависимости от их локализации и характера выполненного хирургического вмешательства. В классификации Robbins и соавт. выделено шесть уровней лимфатических узлов.
В этой классификации помимо прочего не учтены позадиушные, предушные, заглоточные и затылочные лимфатические узлы. Цель классификации заключалась в том, чтобы облегчить хирургам выполнение лимфодиссекции с учетом преимущественных путей лимфогенного распространения опухоли верхних дыхательных путей и начального отдела ЖКТ, сохраняющих относительное постоянство и предсказуемых, хотя, разумеется, возможны индивидуальные особенности в характере дренирования лимфы из той или иной области.
P.S. Поражение регионарных лимфатических узлов метастазами достоверно снижает 5-летнюю выживаемость больных, если пораженные лимфатические узлы спаяны с окружающими тканями и подвижность их ограничена, то шансы больного на выживание резко снижаются.
Вирховский лимфатический узел пальпируют в левой надключичной ямке в месте впадения грудного протока в левый венозный угол, образованный внутренней яремной и подключичной венами.
Метастазы в надключичных лимфатических узлах являются противопоказанием к хирургическому лечению злокачественных опухолей органов брюшной и грудной полости, а также женских половых органов.
Лимфа, оттекающая от тканей и органов шеи, прежде чем попасть в кровеносное русло, проходит три эшелона лимфатических узлов.
Хирургическое удаление лимфатических узлов шеи, пораженных метастазами, является важной частью лечения опухолей области головы и шеи.
Метастатические опухоли при неустановленном первичном очаге
Метастатические опухоли при неустановленном первичном очаге (CUP syndrome, Cancer of Unknown Primary) занимают особое место в диагностике и лечении злокачественных опухолей шеи, метастазирующих в регионарные лимфатические узлы. В этих случаях речь идет об одном метастазе или более, подтвержденных гистологическим исследованием, при невыделенной первичной опухоли несмотря на интенсивное обследование в полном объеме.
Метастазы в лимфатические узлы наиболее часто появляются в области головы и шеи. В 50-70% случаев первичная опухоль локализуется также в этой области. В 20-30% случаев первичная опухоль локализуется вне уха, носа и горла.
Согласно одной из гипотез, рост метастатической опухоли оказывается настолько быстрым, что первичная опухоль не успевает проявиться клинически. Возможно также, что речь идет о рецидиве первичной опухоли в силу изменения местного иммунитета. По-видимому, у некоторых больных с метастатической опухолью при неустановленном первичном очаге развитие первичной опухоли происходит «в обход» лимфогенной и гематогенной стадии, поэтому установить ее локализацию бывает трудно.
Диагноз метастатической опухоли при неустановленном первичном очаге ставят лишь после полноценного обследования, включая эндоскопию верхних дыхательных путей и верхнего отдела ЖКТ на фоне общей или местной анестезии, а также методы визуализации, такие как КТ и МРТ. Поскольку в большинстве случаев метастатического плоскоклеточного рака шейных лимфатических узлов первичная опухоль локализуется в нёбной миндалине, корне языка, глотке и грушевидном кармане, диагностика должна включать тонзиллэктомию, биопсию слизистой оболочки носоглотки, глубокую биопсию корня языка, а также слизистой оболочки гортаноглотки.
В зависимости от результатов гистологического исследования, особенно если метастазами поражена глубокая цепочка лимфатических узлов шеи, поиск первичной опухоли следует распространить на органы и ткани, расположенные ниже уровня ключицы, дополняя его при необходимости такими методами визуализации, как КТ и МРТ грудной клетки и живота, а также ПЭТ. Примерно в 30% случаев удается выявить скрытый бронхогенный рак легкого. При необходимости важно привлечь к обследованию и других специалистов (например, пульмонолога, гастроэнтеролога, гинеколога, уролога и др.). В целом, объем диагностических исследований, необходимых для выявления первичной опухоли, зависит от распространенности опухолевого процесса и прогноза, а также общего состояния больного.
Лечение и прогноз. Особенности лечения определяются результатом гистологического исследования и локализацией пораженных метастазами лимфатических узлов. При подозрении на скрыто протекающий плоскоклеточный рак обычно следует выполнить шейную лимфодиссекцию в сочетании с лучевой терапией. Обычно после модифицированной радикальной лимфодиссекции проводят лучевую терапию, включая в облучаемое поле область, дренируемую пораженными метастазами лимфатическими узлами. После такого комбинированного лечения 5-летняя выживаемость в среднем составляет 50-60% (если поражение охватывает верхнюю группу лимфатических узлов шеи и оценивается как N1 или N2).
Если первичной опухолью является аденокарцинома, то наличие метастазов в шейных регионарных лимфатических узлах всегда указывает на далеко зашедший опухолевый процесс, и тактику лечения в таком случае следует выбирать индивидуально с учетом потребностей и ожиданий больного. При поражении метастазами верхних шейных лимфатических узлов можно выполнить лимфодиссекцию с последующей лучевой терапией. При поражении глубоких шейных лимфатических узлов возможно только паллиативное лечение. Пятилетняя выживаемость больных с таким поражением составляет 0-28%.
При метастатическом поражении шейных лимфатических узлов скрытой меланомой выполняют модифицированную радикальную лимфодиссекцию шеи.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика лимфаденопатий
Общая информация
Краткое описание
Национальное гематологическое общество
НАЦИОНАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ ЛИМФАДЕНОПАТИЙ
2018
Анализ публикаций отечественных [1—5,8] и зарубежных [12—14] авторов, посвященных алгоритмам диагностики ЛАП, а также многолетний опыт работы «НМИЦ гематологии» [5] позволили разработать и внедрить протокол дифференциальной диагностики лимфаденопатий [15—17].
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Диагностика
Первый этап заключается в сборе жалоб, данных анамнеза жизни и анамнеза заболевания, эпидемиологического анамнеза и физикального исследования (рис.1) (II A).
Рисунок 1. Алгоритм первичной диагностики пациентов с ЛАП 
Жалобы и анамнез:
Таблица 1. Эпидемиологические данные, профессиональные факторы, важные в диагностике лимфаденопатий. 
Таблица 3. Географическое распространение основных эндемичных инфекционных заболеваний, сопровождающихся лимфаденопатией.
Таблица 4. Локализация лимфатических узлов, зоны дренирования лимфы и наиболее частые причины увеличения. 

Таблица 5. Значение клинических признаков при лимфаденопатии. 

Уровень убедительности рекомендаций В (уровень достоверности доказательств – IIВ).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – II).
3. Правила выбора лимфатического узла и выполнения его биопсии:

Алгоритм дифференциальной диагностики после проведения биопсии лимфатического узла представлен на рисунке 2 и основан на выявленных морфологических изменениях. В случаях с морфологической картиной опухолевого поражения (лимфома или нелимфоидная опухоль) проводиться ряд дополнительных исследований (иммуногистохимическое и/или молекулярно-генетическое исследование) для уточнения нозологической формы согласно ВОЗ классификации. При отсутствии опухолевого поражения, устанавливается гистологический вариант ЛАП согласно дифференциально-диагностическим группам (таблица 6), в зависимости от которого проводятся/непроводятся дополнительные исследования – повторный сбор жалоб, данных анамнеза жизни, заболевания, объективного осмотра, лабораторное и инструментальное исследования (рисунок 2).
Рисунок 2. Алгоритм постбиопсийной диагностики ЛАП 
Лечение
Вид терапии зависит от окончательного диагноза, установленного после обследования, единого стандарта лечения лимфаденопатии не существует. Проводить консервативное лечение следует в случае доказанной неопухолевой природы ЛАП:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – III).
Медицинская реабилитация
Профилактика
Информация
Источники и литература
Информация
Они предназначены для врачей-гематологов, онкологов, терапевтов, инфекционистов, хирургов, педиатров, работающих в амбулаторно-поликлинических условиях, организаторов здравоохранения.
Поспелова Татьяна Ивановна, д.м.н., профессор, заведующая кафедрой терапии, гематологии и трансфузиологии Федерального государственного бюджетного образовательного учреждения высшего образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
Метастазы злокачественных опухолей без выявленного первичного очага. Клинические рекомендации.
Метастазы злокачественных опухолей без выявленного первичного очага
Оглавление
Ключевые слова
Список сокращений
ВПО – выявленный первичный очаг
КТ – компьютерная томография
ПЭТ-КТ – позитронно-эмиссионная томография, совмещенная с КТ
Термины и определения
Новые термины и определения в рекомендациях не используются.
1. Краткая информация
1.1 Определение
Метастазы злокачественной опухоли без выявленного первичного очага (ВПО) – заболевание, проявляющееся метастатическими опухолями, в то время как первичный очаг невозможно установить ни на основании анамнеза, ни при обследовании [13].
1.2 Этиология и патогенез
В связи с большой гетерогенностью опухоли обычно не удается выделить, какой клон клеток явился источником метастазирования, так как теряется набор морфологических признаков, позволяющих отличить клетки по органопринадлежности [1, 2,3]. В среднем идентификация первичного источника осуществляется при жизни только у 25% больных. В 15-20% случаев первичный очаг не находят даже на аутопсии [4, 5]. Хотя метастазы без ВПО отличаются своим происхождением из разных органов, биологическое поведение их приблизительно одинаково. Зачастую они характеризуются случайной, нетипичной локализацией, (то есть поражением не регионарных лимфатических узлов), а также быстрым прогрессированием процесса на самых ранних этапах развития.
1.3 Эпидемиология
По данным различных авторов пациенты с метастазами без ВПО составляют от 3 до 5% онкологических больных, обратившихся за медицинской помощью [6, 7, 8]. Опухоли без ВПО занимают 7 место по частоте встречаемости и 4 место в структуре смертности среди всех злокачественных новообразований [5, 9, 10].
У мужчин и женщин опухоли без ВПО встречаются приблизительно с одинаковой частотой. С увеличением возраста кривая заболеваемости резко поднимается вверх, достигая пика к 65 годам [4, 7, 11].
1.4 Кодирование по МКБ 10
Злокачественные новообразования неточно обозначенных, вторичных и неуточненных локализаций (C76-C80):
Злокачественное новообразование других и неточно обозначенных локализаций (C76):
C76.0 — Головы, лица и шеи;
C76.1 — Грудной клетки;
C76.4 — Верхней конечности;
C76.5 — Нижней конечности;
C76.7 — Других неуточненных локализаций;
C76.8 — Поражение других и неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций.
Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77):
C77.0 — Лимфатических узлов головы, лица и шеи;
C77.1 — Внутригрудных лимфатических узлов;
C77.2 — Внутрибрюшных лимфатических узлов;
C77.3 — Лимфатических узлов подмышечной впадины и верхней конечности грудных лимфатических узлов;
C77.4 — Лимфатических узлов паховой области и нижней конечности;
C77.5 — Внутритазовых лимфатических узлов;
C77.8 — Лимфатических узлов множественных локализаций;
C77.9 — Лимфатических узлов неуточненной локализации;
Вторичное злокачественное новообразование органов дыхания и пищеварения (C78):
C78.0 — Вторичное злокачественное новообразование легкого;
C78.1 — Вторичное злокачественное новообразование средостения;
C78.2 — Вторичное злокачественное новообразование плевры;
C78.3 — Вторичное злокачественное новообразование других и не уточненных органов дыхания;
C78.4 — Вторичное злокачественное новообразование тонкого кишечника;
C78.5 — Вторичное злокачественное новообразование толстого кишечника и прямой кишки;
C78.6 — Вторичное злокачественное новообразование забрюшинного пространства и брюшины;
C78.7 — Вторичное злокачественное новообразование печени;
C78.8 — Вторичное злокачественное новообразование других и неуточненных органов пищеварения;
Вторичное злокачественное новообразование других локализаций (C79):
C79.0 — Вторичное злокачественное новообразование почки и почечных лоханок;
C79.1 — Вторичное злокачественное новообразование мочевого пузыря, других и неуточненных мочевых органов;
C79.2 — Вторичное злокачественное новообразование кожи;
C79.3 — Вторичное злокачественное новообразование головного мозга и мозговых оболочек;
C79.4 — Вторичное злокачественное новообразование других и неуточненных отделов нервной системы;
C79.5 — Вторичное злокачественное новообразование костей и костного мозга;
C79.6 — Вторичное злокачественное новообразование яичника;
C79.7 Вторичное злокачественное новообразование надпочечника;
C79.8 — Вторичное злокачественное новообразование других уточненных локализаций;
Злокачественное новообразование без уточнения локализации (C80).
1.5 Классификация
В соответствии с гистологическим строением опухоли ВПО, согласно рекомендациям ESMO (2015г), целесообразно разделять на следующие группы [12]:
1) высокодифференцированные и умеренно дифференцированные аденокарциномы;
2) низкодифференцированные карциномы;
3) плоскоклеточный рак;
4) недифференцированная опухоль;
5) рак с нейроэндокринной дифференцировкой.
Стадирование.
Так как заболевание на первых этапах проявляется метастазами, можно говорить о первично генерализованном процессе, который к моменту обращения пациента за медицинской помощью, как правило, выходит за пределы органа. Более конкретизированного общепринятого стадирования метастазов злокачественной опухоли без ВПО в настоящее время не существует.
В зависимости от локализации и распространенности метастатического поражения больных делят на группы [13]:
3. Пациенты с поражением нескольких коллекторов лимфоузлов, сочетанное поражение лимфоузлов и/или органов.
2. Диагностика
Диагностический алгоритм у больных с метастатическим поражением без ВПО включает четыре направления: предварительная дифференцировка и оценка общего состояния, оценка распространенности опухолевого поражения, получение материала для морфологического исследования, поиск первичного очага.
Следует отметить, что важным фактором в выборе диагностической тактики является общее состояние больного. Очевидно, что пациенту в тяжелом состоянии не имеет смысла проводить обследование в полном объеме, так как в большинстве случаев не приходится надеяться на эффективное лечение, а в особо тяжелых случаях следует обсудить вопрос о симптоматической терапии без обследования.
2.1 Жалобы и анамнез
2.2 Физикальное обследование
2.3 Лабораторная диагностика
2.4 Инструментальная диагностика
Комментарии: при цитологическом исследовании метастазов без ВПО наиболее часто встречаются: умеренно дифференцированная или высокодифференцированная аденокарцинома в 50% случаях, низкодифференцированная или недифференцированная аденокарцинома или рак в 30%, плоскоклеточный рак у 15% больных и недифференцированная опухоль – 5% [16, 17]. Реже выявляют опухоли с нейроэндокринной дифференцировкой, меланому, лимфомы, герминогенные опухоли, саркомы, эмбриональный рак.
Комментарии: морфологическое исследование является наиболее значимым и должно выполняться как можно раньше. Полученные данные позволяют подтвердить злокачественность процесса, определить гистогенез опухоли, степень дифференцировки клеток, а иногда и предположительную локализацию первичной опухоли, что значительно облегчает поиск первичного очага и сокращает количество диагностических манипуляций. На этом этапе пациенты распределяются на группы: нет признаков злокачественного роста; метастазы рака; лимфома; метастазы меланомы; метастазы злокачественной опухоли без уточнения гистогенеза. Больные первой группы из дальнейшего исследования исключаются. При выявлении лимфомы дальнейшее обследование и лечение проводится гематологом.
В соответствии с гистологическим строением опухоли без ВПО, согласно рекомендациям ESMO (2015г), целесообразно разделять на следующие группы: высокодифференцированные и умеренно дифференцированные аденокарциномы; низкодифференцированные карциномы; плоскоклеточный рак; недифференцированная опухоль; рак с нейроэндокринной дифференцировкой. Подобная дифференцировка пациентов позволяет в последующем выработать оптимальную схему лечения пациента [12].
Комментарии: иммуногистохимический метод повышает точность патологоанатомического исследования за счёт более корректного определения или уточнения гистогенеза, направления клеточной дифференцировки и органной принадлежности первичной опухоли. У пациентов с метастазами без чётких морфологических признаков железистой (аденогенной), нейроэндокринной или плоскоклеточной дифференцировки главной задачей дополнительных методов исследования является уточнение гистогенеза опухоли (точнее установление направления дифференцировки опухолевых клеток).
2.5 Дополнительная диагностика
Комментарии: применение ПЭТ-КТ при множественных метастазах иногда не дает желаемого результата, так как трудно отличить первичную опухоль от метастазов. Низкая метаболическая активность для 19F-ФДГ характерна также для бронхоальвеолярного рака, гепатоцеллюлярной карциномы, рака почки, карциноида, низкодифференцированных и некоторых других опухолей. По рекомендациям NCCN от 2016 года ПЭТ-КТ не рекомендуется в качестве первичного диагностического теста [18]. Однако существуют благоприятные подгруппы для данного вида исследования: это немногочисленные или единичные метастазы, а также метастазы плоскоклеточного рака в шейных лимфатических узлах. У таких пациентов ПЭТ-КТ может изменить тактику лечения в 30-35% случаев.
Комментарии: эндоскопические методы исследования выполняются в зависимости от жалоб, симптоматики и результатов лабораторных анализов.
Комментарии: получение материала для морфологического исследования не представляет трудности при поражении периферических лимфатических узлов. В случае поражения медиастинальных или забрюшинных лимфатических узлов выполняется чрезкожная пункция под контролем УЗТ или КТ. Если материала недостаточно для всестороннего гистологического исследования, может обсуждаться вопрос о торакоскопии или лапароскопии с биопсией. Аналогичная тактика оправдана и при поражении органов грудной и брюшной полостей, плевры, брюшины, органов и тканей забрюшинного пространства. Если метастазы локализуются в костях, последовательность диагностических процедур такова: пункция, трепанобиопсия, открытая биопсия пораженной кости.
3. Лечение
Поскольку первичный очаг остается неизвестным, любое проведенное лечение можно обозначить «радикальным» только условно. Поэтому выбор лечебной тактики у данной категории больных представляет собой проблему, разрешаемую в каждом конкретном случае в индивидуальном порядке. Лечебная тактика определяется, в первую очередь, с учетом общего состояния больного, локализации метастазов, распространенности опухолевого процесса, морфологического строения метастатической опухоли, предполагаемой локализации первичного очага.
В последнее время осуществляются программы по выработке лечебной тактики не на основании предполагаемой локализации первичного очага, а на основании биологических характеристик опухоли, что позволит индивидуализировать лечение и шире использовать таргетную терапию. Доказано, что средняя продолжительность жизни пациентов, получавших специальное лечение, достоверно выше, чем у лиц, лечение которых ограничилось симптоматической терапией. Лучшие результаты пятилетней выживаемости отмечены у больных с изолированными метастазами в паховых, подмышечных, шейных лимфатических узлах, получавших специальное лечение.
Хирургический метод лечения у больных с метастазами злокачественной опухоли без ВПО не является радикальным и может быть использован при изолированном поражении лимфоузлов доступной удалению группы и в некоторых случаях изолированного поражения органа; возможна лимфаденэктомия или удаление метастаза с резекцией органа. Также оперативное вмешательство возможно с симптоматической целью.
Лучевая терапия при невозможности применения хирургического метода может быть показана при изолированном поражении лимфатических узлов или органа при потенциальной чувствительности опухоли к облучению. Возможно применение ЛТ и с симптоматической целью.
Так как опухоль невыясненной первичной локализации предполагает диссеминированный процесс, основным методом лечения является лекарственная терапия. Лечение осуществляется персонализировано на основе всех имеющихся клинико-морфологических данных. Решающее значение имеют морфологические характеристики опухоли и потенциальная чувствительность к тем или иным препаратам. При выявлении в опухоли соответствующих мутаций возможно применение таргетной терапии. В случаях изолированного поражения комбинация химиотерапии с хирургическим и лучевым методами позволяет добиться достоверно лучших результатов.
В рекомендациях Российского профессионального общества онкологов-химиотерапевтов (RUSSCO) и Европейского общества медицинской онкологии (ESMO) в каждом конкретном случае предлагается определить пациента в ту или иную группу в зависимости от распространенности опухолевого поражения и морфологической структуры опухоли, которые соответствуют заболеванию с известной локализацией первичной опухоли [12,24].
3.1 Метастазы плоскоклеточного рака в лимфатических узлах головы и шеи без выявленного первичного очага
3.2 Метастазы рака в подмышечных лимфатических узлах у женщин
Комментарии: при сомнительной радикальности лимфаденэктомии или невозможности её выполнения из-за распространенности опухолевого поражения показана лучевая терапия на аксиллярную и шейно-над-подключичную зоны.
3.3 Канцероматоз брюшины у женщин
Комментарии: как правило, течение заболевания соответствует раку яичников, поэтому лекарственное лечение проводится по аналогичным схемам.
3.4 Метастазы недифференцированной/низкодифференцированной карциномы с преимущественным поражением лимфатических узлов осевой локализации (шейные, медиастинальные, забрюшинные)
Комментарии: заболевание по течению соответствует герминогенным опухолям. Необходимо обратить внимание на уровни АФП, ХГЧ, лактатдегидрогеназы (ЛДГ).
3.5 Метастазы низкодифференцированной нейроэндокринной карциномы
Течение заболевания у пациентов этой группы соответствует мелкоклеточному раку легкого.
3.6 Метастазы высокодифференцированной нейроэндокринной карциномы с низкой пролиферативной активностью
Комментарии: заболевание по течению наиболее соответствует нейроэндокринным опухолям желудочно-кишечного тракта, поэтому лечение проводится по аналогичным схемам, предложенным для терапии больных опухолями этой локализации.
3.7 Остеобластические метастазы аденокарциномы в скелет у мужчин
3.8 Метастатическое поражение, не соответствующее вышеперечисленным группам
Как правило, речь идет о диссеминированном опухолевом процессе. Назначение лекарственного лечения возможно пациентам в удовлетворительном состоянии.
Комментарии: во всех группах оценка эффективности лечения проводится через 6-8 недель. Терапия продолжается до достижения максимального эффекта плюс 2 закрепляющих эффект цикла. Лучевое воздействие у больных без ВПО может быть применено при невозможности радикального хирургического удаления опухоли или конгломерата лимфатических узлов с паллиативной или радикальной целью с применением стандартной или стереотаксической лучевой терапии.
4. Реабилитация
5. Профилактика и диспансерное наблюдение
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов и рецидивных опухолей, а также выявление первичного очага.
Критерии оценки качества медицинской помощи
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнено хирургическое вмешательство
Выполнена анестезия в соответствии с объемом оперативного вмешательства и тяжестью состояния пациента
Отсутствие повторных хирургических вмешательств в период госпитализации
Выполнено морфологическое исследование препарата удаленных тканей (при хирургическом вмешательстве
Выполнена периоперационная антибиотикопрофилактики (у больных, кому выполнено хирургическое лечение)
Отсутствие тромбоэмболических осложнений в период госпитализации (при хирургическом вмешательстве)
Отсутствие кровотечения в раннем послеоперационном периоде (при хирургическом вмешательстве)
Выполнен 1 курс адъювантной химиотерапии не позднее 28 дня от момента хирургического и при отсутствии медицинских противопоказаний
Список литературы
Приложение А1. Состав рабочей группы
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 – Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 – Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РБ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
1) При повышении температуры тела 38°C и выше:
2) При стоматите
3) При диарее
4) При тошноте