С чем реагирует оксид натрия
Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Оксид натрия, характеристика, свойства и получение, химические реакции
Оксид натрия, характеристика, свойства и получение, химические реакции.
Оксид натрия – неорганическое вещество, имеет химическую формулу Na2O.
Краткая характеристика оксида натрия:
Оксид натрия – неорганическое вещество бесцветного либо белого цвета.
Так как валентность натрия равна одному, то оксид натрия содержит один атом кислорода и два атома натрия.
Химическая формула оксида натрия Na2O.
Оксид натрия в воде не растворяется, а вступает в реакцию с ней. Не растворяется в этаноле, вступает с ним в реакцию.
Оксид натрия относится к опасным веществам. Это едкое вещество, особенно опасен при смешивании с водой.
Физические свойства оксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2O |
| Синонимы и названия иностранном языке | sodium oxide (англ.) |
окись натрия (рус.)
Получение оксида натрия:
Оксид натрия получается в результате следующих химических реакций:
При реакции натрия с кислородом образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия.
Затем пероксид натрия обогащают натрием.
Химические свойства оксида натрия. Химические реакции оксида натрия:
Химически активное вещество.
Химические свойства оксида натрия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
В результате реакции образуется пероксид натрия.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит натрия, во втором случае – сульфат натрия.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат натрия.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль – ортофосфат натрия.
Аналогично проходят реакции оксида натрия и с другими кислотными оксидами.
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат натрия.
Аналогично проходят реакции оксида натрия и с другими амфотерными оксидами.
В результате реакции образуется соль – купрат натрия.
В результате реакции образуется соль – феррат натрия.
В результате реакции образуется соль – плюмбит натрия.
Аналогично проходят реакции оксида натрия и с другими оксидами.
В результате реакции образуются соль нитрит натрия.
В результате химической реакции получается соль – фторид натрия и вода.
Аналогично проходят реакции оксида натрия и с другими кислотами.
В результате химической реакции получается гидроксид натрия и амид натрия.
Оксид натрия в результате термического разложения разлагается на пероксид натрия и натрий.
Применение и использование оксида натрия:
Оксид натрия используется в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида натрия
реакции с оксидом натрия
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
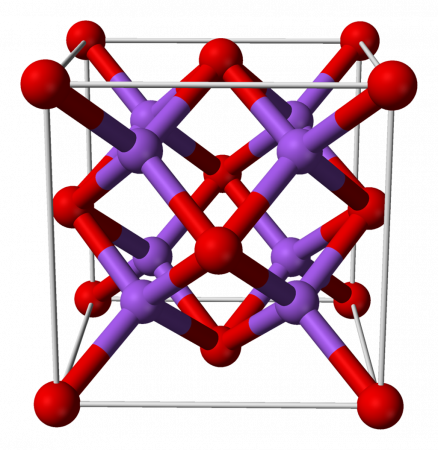
Оксид натрия
| Оксид натрия | |
|---|---|
 | |
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES | |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Содержание
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Оксид натрия
Характеристики и физические свойства оксида натрия
Оксид натрия имеет структуру антифлюорита. Эта структура родственна CaF2, однако катионы и анионы в ней меняются местами, так что атом натрия занимает место фтора, а кислород – кальция.
Рис. 1. Оксид натрия. Внешний вид.
Таблица 1. Физические свойства оксида натрия.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Получение оксида натрия
Оксид натрия синтезируют взаимодействием пероксида, гидроксида, а предпочтительнее всего нитрита натрия с металлическим натрием:
В последней реакции натрий можно заменить азидом NaN3, при этом образуются те же продукты.
Химические свойства оксида натрия
Оксид натрия проявляет сильные основные свойства. Он бурно реагирует с водой с образованием гидроксида натрия и выделением большого количества теплоты:
Оксид натрия реагирует с кислотами (1), кислотными (2, 3) и амфотерными оксидами (4), жидким аммиаком (5):
При нагревании до температуры выше 700 o С оксид натрия разлагается на пероксид натрия и натрий:
Применение оксида натрия
Основное направление использования оксида натрия – неорганический синтез: производство гидроксида натрия и других веществ.
Примеры решения задач
| Задание | Вычислите массу оксида натрия, который потребуется для получения карбоната натрия по реакции взаимодействия с диоксидом углерода массой 5,5 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и диоксида углерода с образованием карбоната натрия: |
Рассчитаем количество вещества диоксида углерода (молярная масса – 44 г/моль):
n (CO2) = 5,5 / 44 = 0,125моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
m (Na2O) = 0,125 × 62 = 7,75г.
| Задание | Вычислите массу оксида натрия, который потребуется для получения гидроксида натрия по реакции взаимодействия с водой массой 100 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и воды с образованием гидроксида натрия: |
Рассчитаем количество вещества воды (молярная масса – 18 г/моль):
n (H2O) = 100 / 18 = 5,6 моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
Формула оксида натрия (Na2O), свойства, риски
оксид натрия неорганическое соединение формулы Na2О. Как и все оксиды щелочных металлов, он имеет кристаллическую структуру, похожую на антифторит (аналог флюорита, CaF2, но с катионами и инвертированными анионами), что соответствует граням с кубической центрированностью. (Натрий: динатрийоксид, 1993-2016).
Можно сказать, что оксид натрия является ангидридом гидроксида натрия, поскольку он реагирует с водой, образуя два моля этого соединения следующим образом:
Как правило, название KNaO можно найти, ссылаясь на оксид натрия или оксид калия. Это связано с тем, что два оксида имеют сходные свойства с точки зрения цвета и скорости расширения и сжатия..
Часто нерастворимые источники оксида натрия включают следы оксида калия, например, в полевых шпатах (рисунок 2), которые являются основным источником натрия в определенных эмалях (Britt, 2007).
Физико-химические свойства
Оксид натрия представляет собой белое кристаллическое твердое вещество (фиг.3). Он имеет молекулярную массу 61,98 г / моль, плотность 2,27 г / мл и температуру плавления 1275 ° С..
Соединение имеет температуру кипения 1950 ° C, где оно начинает разлагаться до натрия и пероксида металла натрия, однако, интересным свойством является то, что оксид натрия начинает сублимировать при 1100 ° C (Национальный центр биотехнологической информации, SF ).
Реагирует бурно с водой и спиртом с образованием гидроксида натрия. Оксид натрия, Na2Или он обратимо поглощает водород (H2), с образованием гидрида натрия (NaH) и гидроксида натрия (NaOH), который потенциально может найти свое применение для обратимого хранения водорода.
Реактивность и опасности
Оксид натрия является стабильным негорючим соединением, но может бурно реагировать с кислотами и водой. Это может также увеличить сгорание других веществ. Он классифицируется как разъедающий и может обжечь кожу и глаза (Королевское химическое общество, 2015).
Раствор в воде является сильной основой, поскольку он бурно реагирует с кислотами, вызывающими коррозию. При бурной реакции с водой образуется гидроксид натрия, который в присутствии воды атакует многие металлы.
Вещество также вызывает коррозию дыхательных путей и проглатывания. Вдыхание аэрозоля может вызвать отек легких (Национальный институт безопасности и гигиены труда, 2014).
В случае вдыхания пострадавшего следует перенести в прохладное место. Если пострадавший не дышит, следует применять искусственное дыхание. Тогда сходите или обратитесь к врачу как можно скорее.
В случае попадания на кожу загрязненную одежду и обувь следует немедленно снять и вымыть большим количеством воды..
При попадании в глаза промойте их большим количеством воды не менее 15 минут и обратитесь к врачу. В случае проглатывания не думайте о рвоте, а прополощите рот водой и обратитесь к врачу..
Наиболее важными симптомами и эффектами могут быть: судороги, отек и отек гортани и бронхов, пневмонит, отек легких, ощущение жжения, кашель, одышка, ларингит и затрудненное дыхание (оксид натрия (Na2O) (cas 1313- 59-3) MSDS, 2010-2017).
Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Поэтому отдых и медицинское наблюдение необходимы.
Оксид натрия следует хранить в сухом месте и отделять от сильных кислот. Поскольку соединение бурно реагирует с водой, в случае пожара не следует использовать огнетушители или разбрызгиватели на водной основе. Рекомендуется использовать сухие порошки или песок.
приложений
Основное использование оксида натрия в производстве стекла. Это используется в керамике и очках, хотя не в необработанном виде. Оксид натрия обычно составляет около 15% химического состава стекла.
Это снижает температуру, при которой расплавляется диоксид кремния (состав стекла на 70%), что делает его более дешевым и более эффективным для производства стекла, поскольку требует меньших затрат энергии со стороны производителя (Джордж Самнер, научный сотрудник ).
Натриево-известковое стекло является наиболее распространенной формой производимого стекла, состоящего примерно из 70% диоксида кремния (диоксид кремния), 15% соды (оксид натрия) и 9% извести (оксид кальция), причем гораздо больше небольшое количество других соединений.
Оксид натрия служит флюсом для понижения температуры, при которой кремнезем плавится, а известь действует как стабилизатор для кремнезема. Натриево-известковое стекло дешевое, химически стабильное, достаточно твердое и чрезвычайно работоспособное, поскольку его можно несколько раз смягчить при необходимости.
Эти качества делают его пригодным для изготовления широкого ассортимента стеклянных изделий, в том числе лампочек, стаканов, бутылок и предметов искусства..
С другой стороны, оксид натрия и диоксид кремния содержат кристаллы воды, также называемые силикатом натрия или жидким стеклом, которые образуют стекловидное тело с очень полезным свойством растворимости в воде..
Жидкое стекло продается в виде твердых комочков или порошков или в виде прозрачной сиропообразной жидкости. Он используется в качестве удобного источника натрия для многих промышленных продуктов, таких как: производитель моющих средств для стирки, в качестве связующего вещества и клея, в качестве флокулянта на водоочистных сооружениях и во многих других применениях (Enciclopaedia britannica, 2017).
Оксидные соединения не приводят к электричеству. Однако некоторые структурированные оксиды перовскита являются электронными проводниками для применения в катоде твердооксидных топливных элементов и систем генерации кислорода (American Elements, 1998-2017)..














